|
一:
物理性质
砷、锑和铋都有金属的外形,性脆,
熔点低, 易挥发,
锑和铋是电和热的良导体,但与一般金属不同,锑、铋固体的导电、导热性反而比它们熔融态的导电、导热性能差。在气态时,砷、锑、铋都是多原子分子,如砷和锑组成为As4和Sb4,铋蒸气中,单原子分子和双原子分子处于平衡状态。它们的主要物理性质列于下表中。
|
名
称 |
砷 |
锑 |
铋 |
|
气体分子组成 |

|

|
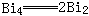
|
|
熔点/K |
1090 |
903 |
544 |
|
沸点/K |
889(升华) |
1908 |
1853 |
|
密度/g·cm-3 |
5.78(金属) |
6.68(金属) |
9.80 |
|
从液态转为固态时的体积变化 |
缩小10% |
缩小0.8% |
缩小3.35% |
和磷相似,砷、锑都有同素异形体。砷的同素异形体有黄砷、黑砷和灰砷(即金属砷),锑的为黄锑、黑锑和灰锑(金属锑),而铋没有同素异形体。
二: 化学性质
常温下砷、锑、铋在水和空气中都比较稳定,在高温时能和氧、硫、卤素反应。
砷、锑、铋都不溶于稀酸,但能和硝酸、热浓硫酸、王水等反应。 砷可与熔融的NaOH反应,而锑、铋却不与NaOH作用。
砷、锑、铋能和许多金属形成化合物,如和碱金属形成A3M型化合物(A为碱金属),和ⅢA族元素化合形成ⅢA-ⅤA族半导体材料,如砷化镓GaAs、砷化铟InAs、锑化镓GaSb、锑化铝AlSb等。砷、锑、铋还能和许多金属形成合金,这些合金在国民经济中都有很重要的意义。

砷、锑、铋都能生成氢化物MH3,它们的氢化物都是无色有恶臭和有毒的气体,极不稳定。它们氢化物和氨、膦性质的对比见下表。
|
物
质 |
NH3 |
PH3
|
AsH3
|
SbH3
|
BiH3
|
|
熔
点/K
沸
点/K
熔化热/kJ.mol-1
气化热/kJ.mol-1
生成热/kJ.mol-1
密度(沸点时,液体)/g.cm-3
键 长/pm
键 角
气态分子偶极矩/×10-30C.m
|
195.3
239.6
23.65
23.35
-46.2
0.618
102
106.6º
4.80 |
141
185.6
16.03
14.61
5.4
0.765
142
93.08º
1.83
|
156
210.5
18.17
16.74
66.4
1.621
152
91.8º
0.50
|
185
254.6
21.26
20.93
145.1
2.204
171
91.3º
-
|
-
290
-
25.10
277.8
-
-
-
-
|
|
稳
定 性
还 原 性
|
依次递减
→
依次递增 →
|

砷、锑、铋所有三卤化物均已制得,而已知的五卤化物只有AsF5、SbF5、SbCl5和BiF5四种。它们三卤化物的一些物理性质列于下表。
|
X |
性质 |
AsX3 |
SbX3 |
BiX3 |
|
F
|
颜色,形态 |
无色液体 |
无色固体 |
灰白色固体 |
|
熔点(K) |
267 |
565 |
998-1003 |
|
Cl
|
颜色,形态 |
无色液体 |
无色固体 |
白色固体 |
|
熔点(K) |
256.8 |
346 |
506.5 |
|
Br
|
颜色,形态 |
无色固体 |
无色固体 |
黄色固体 |
|
熔点(K) |
304 |
370 |
492 |
|
I
|
颜色,形态 |
红色固体 |
红色固体 |
固体 |
|
熔点(K) |
413 |
444 |
681 |
砷、锑、铋的三卤化物在溶液中都会强烈地水解,因为它们相应氧化物的水合物不是弱酸便是强酸,随着As、Sb、Bi顺序碱性逐渐增强,其水解程度逐渐减弱。另外,它们的水解产物是不同的。卤化砷水解后生成相应的氢卤酸和亚砷酸,而锑和铋的卤化物水解后生成难溶的SbOX和BiOX(其中X代表卤素离子)酰基盐。

砷分族元素均可生成氧化态为+Ⅲ的氧化物及其水合物,它们的一些性质列于下表中。
|
性
质 |
三氧化二砷 |
三氧化二锑 |
三氧化二铋 |
|
分子式 |
As4O6(>2073K为As2O3) |
Sb4O6(>2073K为Sb2O3) |
Bi2O3 |
|
酸碱性 |
两性偏酸 |
两性 |
弱碱性 |
|
溶解度(g/100g水) |
2.04(298K) |
0.002(288K) |
极难溶 |
|
生成热(kJ/mol) |
-1314 |
-705(Sb2O3) |
-577.0 |
|
与酸作用 |
浓酸,
生成As+离子如AsCl3 |
生成氧基盐如(SbO)2SO4 |
生成正盐如Bi(NO3)3或(BiO)2SO4 |
|
与碱作用 |
生成亚砷酸盐 |
生成亚锑酸盐 |
- |
|
水合物分子式 |
H3AsO3 |
Sb(OH)3 |
Bi(OH)3 |
|
酸碱性 |
两性偏酸 |
两性 |
弱碱性 |
砷,锑,铋+Ⅲ氧化物的另一重要性质是氧化还原性。按As、Sb、Bi的顺序,+Ⅲ氧化态的还原性依次减弱。
砷,锑,铋+Ⅴ氧化物的突出性质是氧化性,但他们强度不同,且从As,Sb到Bi,其+Ⅴ氧化态的氧化性依次增强。
砷分族元素+3和+5价氧化物及其水合物的酸碱性归纳于下表。
|
-
|
砷
|
锑
|
铋
|
|
氧化态
|
+Ⅲ
|
As4O6
H3AsO3
两性偏酸性
|
Sb4O6
Sb(OH)3
两性偏碱性
|
Bi2O3
Bi(OH)3
弱碱性
|
|
+Ⅴ |
As2O5
H3AsO4
弱酸性
|
Sb2O5
H[Sb(OH)6]
两性偏酸性
|
-
|
|
酸碱性递变规律
|
(1)从As到Bi碱性递增酸性递减;
(2)同一元素+Ⅴ氧化态的酸性比+Ⅲ氧化态的强。
|

一:硫化物 砷、锑、铋都能生成有颜色的硫化物沉淀,它们的某些性质见下表所示。
|
硫化物
|
As2S3
|
Sb2S3
|
Bi2S3
|
As2S5
|
Sb2S5
|
|
颜色
|
黄色
|
橙红
|
棕黑
|
黄色
|
橙红
|
|
酸碱性
|
两性偏酸
|
两性
|
碱性
|
酸性
|
酸性
|
|
在浓HCl中
|
不溶
|
溶
|
溶
|
不溶
|
溶*
Sb(+5)→Sb(+3)
|
|
在NaOH中
|
溶
|
溶
|
不溶
|
溶
|
溶
|
|
在Na2S或(NH4)2S中
|
溶
|
溶
|
不溶
|
易溶
|
易溶
|
As2S3和Sb2S3都具有还原性,与多硫化物反应生成硫代酸盐,而Bi2S3的还原性极弱不与多硫化物作用。
二:硫代酸盐
所有硫代酸盐和硫代亚酸盐都只能存在于中性或碱性介质中,遇酸反应生成硫代酸和硫代亚酸,它们很不稳定,在生成时就分解放出H2S并析出硫化物。利用上述反应在分析化学中用于这些元素的鉴定和分离。

|