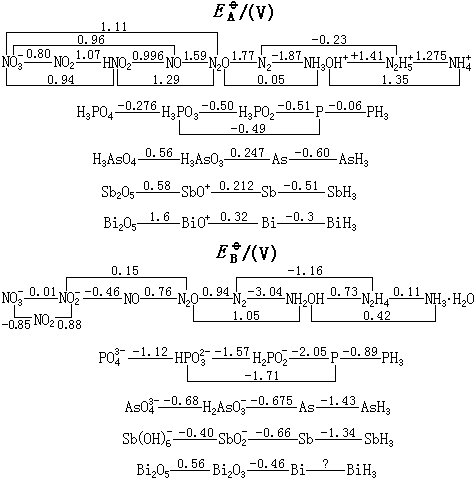|
周期系中ⅤA族包括氮、磷、砷、锑、铋五种元素,通称为氮族元素。其中半径较小的N和P是非金属元素,随着原子半径的增大,Sb和Bi过渡为金属元素,处于中间的As为准金属元素。因此,本族元素在性质上表现出从典型的非金属逐渐递变过渡到金属。
本族元素原子的价电子构型为ns2np3,主要氧化态有-Ⅲ、+Ⅲ和+Ⅴ.由于氮族元素的电负性均小于同周期相应的ⅦA、ⅥA族元素,它与卤素或氧、硫反应主要形成氧化态为+Ⅲ,+Ⅴ的共价化合物;与氢反应形成氧化态从-Ⅲ到+Ⅲ的共价型氢化物;因此形成共价化合物是本族元素的特征。
氮族元素的标准电极电势列于下面。
|