|
一:
物理性质
砷是一个类金属的非金属元素,具有金属光泽。它有三种同素异形体:黄砷,黑砷和灰砷。黄砷有砷蒸气骤冷而得,能溶于二硫化碳,性质活泼,密度为2.026g/cm3。黑砷由加热砷化氢而制得,密度为4.7g/cm3,性质较不活泼。灰砷能稳定存在,有金属性,密度为5.727G/cm3。三种同素异形体的物理性质有所不同,但化学性质却完全相同。 单质砷的熔点为1090K(2.8MPa下),889K时升华,密度为5.78g/cm3,砷蒸气的分子式是As4,为正四面体结构。当受热到1073K时,开始分解为As2,约2000K时,砷蒸气组成几乎全是As2。
二: 化学性质
常温下砷在水和空气中都比较稳定,在高温时能和氧、硫、卤素反应。
砷不溶于稀酸,但能和硝酸、热浓硫酸、王水等,也熔于强碱:
2As + 3H2SO4(热、浓)  As2O3
+ 3SO2↑+ 3H20
As2O3
+ 3SO2↑+ 3H20
2As + 6NaOH(熔融)  2Na3AsO3
+ 3H2↑
2Na3AsO3
+ 3H2↑
在高温时,砷可以和氧、硫、卤素等发生作用:
4As + 3O2  2As2O3
2As2O3
2As + 3S  As2S3
As2S3
2As + 3X2  2AsX3
(X代表卤素,对于F2,还可形成AsF5)
2AsX3
(X代表卤素,对于F2,还可形成AsF5)
砷能和许多金属形成化合物,如和碱金属形成M3As型化合物(M为碱金属),和ⅢA族元素化合形成ⅢA-ⅤA族半导体材料,如砷化镓GaAs。砷还能和许多金属形成合金,这些合金在国民经济中都有很重要的意义。

砷化氢又称胂,它具有大蒜气味,剧毒,吸入少量即很危险。胂不稳定,室温下在空气中发生自燃。
2AsH3 + 3O2  As2O3
+ 3H20
As2O3
+ 3H20
砷化氢(又称胂)在缺氧条件下,受热分解为单质砷。
2AsH3 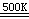 2As
+ 3H2
2As
+ 3H2
析出的砷聚集在器皿的冷却部位形成亮黑色的“砷镜”,此即所谓马氏试砷法,能检出0.007mgAs。“砷镜”能为次氯酸钠所溶解。
5NaClO + 2As + 3H2O
 2H3AsO4
+ 12Ag↓ 2H3AsO4
+ 12Ag↓
据此来与“锑镜”区分(SbH3分解时也形成类似的“锑镜”,但“锑镜”却不溶于次氯酸钠)。
胂的还原性很强,与AgNO3反应便有黑色Ag析出,此反应也是检出砷的方法。
2AsH3 + 12AgNO3 +
3H2O  As2O3
+ 12HNO3 + 12Ag↓ As2O3
+ 12HNO3 + 12Ag↓

砷的三卤化物在溶液中会强烈地水解,生成相应的氢卤酸和亚砷酸。
AsX3 + 3H2O
 H3AsO3
+ 3HX H3AsO3
+ 3HX

一:三氧化二砷及亚砷酸
As2O3是砷的重要化合物,俗称砒霜,是剧毒的白色粉状固体,致死量为0.1g。As2O3中毒时,可服用新制的Fe(OH)2(把MgO加入到FeSO4溶液中强烈摇动制得)悬浮液来解毒。As2O3微溶于水(2.04g/100gH2O,298K)生成亚砷酸,H3AsO3仅存在于溶液中,As2O3是两性略偏酸的物质。
As2O3 +
6NaOH  2Na3AsO3
+ 3H2O 2Na3AsO3
+ 3H2O
As2O3 +
6HCl  2AsCl3 + 3H2O 2AsCl3 + 3H2O
+Ⅲ的砷主要表现还原性,是较强还原剂,它能还原象碘这样弱的氧化剂:
AsO33- + I2
+ 2OH-  AsO43-
+ 2I- + H2O AsO43-
+ 2I- + H2O
该反应方向受溶液pH值的控制。而+Ⅲ氧化态的锑和铋还原性却不如As(+Ⅲ),且按As、Sb、Bi顺序还原性依次减弱。 二:五氧化二砷及砷酸
As2O5是酸性氧化物,易溶于水,是H3AsO4的酸酐。砷酸的强度与磷酸相似,也是三元酸,K1=6.3×10-3,K2=1.0×10-7,K3=3.2×10-12(298K)。
砷酸及其盐最突出的性质是氧化性,如在酸性溶于中可以氧化I-为I2。

一:硫化物 As2S3为黄色不溶于水的沉淀,它两性偏酸性,所以不溶于浓HCl,只溶于碱:
As2S3
+ 6OH-  AsO33-
+ AsS33- + 3H2O AsO33-
+ AsS33- + 3H2O
As2S3还能溶于碱性硫化物如Na2S或(NH4)2S中:
As2S3
+ 3S2-  2AsS33- 2AsS33-
As2S5的酸性比As2S3的强,因此,它不溶于浓HCl而更易溶于碱性硫化物溶液中。
As2S3具有还原性,与多硫化物反应生成硫代酸盐。
As2S3
+ 3S2-  2AsS43-
+ S 2AsS43-
+ S
二:硫代酸盐
硫代亚砷酸钠(Na3AsS3)和硫代砷酸钠(Na3AsS4)只能存在于中性或碱性介质中,遇酸反应时生成硫代砷酸和硫代亚砷酸,它们很不稳定,在生成时就分解放出H2S并析出硫化物。
2AsS43-
+ 6H+  As2S5↓+
3H2S↑ As2S5↓+
3H2S↑
2AsS33-
+ 6H+  As2S3↓+
3H2S↑ As2S3↓+
3H2S↑ 用这种方法制得的As2S5纯度较高。

|