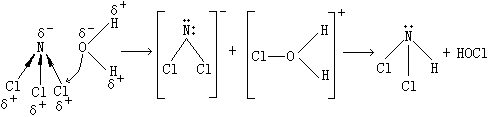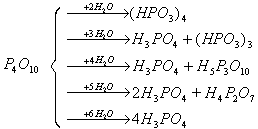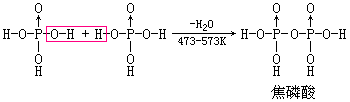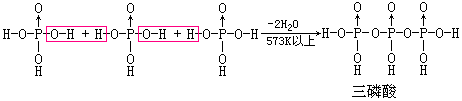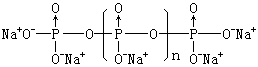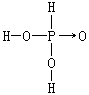|
磷有多种同素异性体,其中主要的有白磷、红磷和黑磷三种。 一:白磷 因P4分子中键角为600,所以P4分子具有张力。这种张力的存在使每一个P—P键的键能减弱,易于断裂,使黄磷在常温下有很高的化学活性。当黄磷发生缓慢氧化时,部分能量以光能形式放出,在暗处可以看到黄磷发光。而黄磷缓慢氧化到表面积聚的热量达到它的燃点(313K)便发生自燃,因此黄磷要贮存于水中以隔绝空气。
P4 + 3KOH + 3H2O
黄磷能将金、铜、银等从它们的盐中还原出来。黄磷与热的铜反应生成磷化亚铜,在冷溶液中则析出铜。 如不慎黄磷沾到皮肤上,可用CuSO4溶液(0.2mol·L-1)冲洗,利用磷的还原性来解毒。 二:红磷
将黄磷隔绝空气加热到533K,它就转变为红磷。
红磷是一种暗红色的粉末,它不溶于水、碱和CS2中,没有毒性,加热到673K以上才着火。在氯气中加热红磷生成氯化物,不象黄磷那样遇到氯气立即着火,但它易被硝酸氧化为磷酸,与KClO3摩擦即着火,甚至爆炸。红磷与空气长期接触也会极其缓慢地氧化,形成易吸水的氧化物,所以红磷保存在未密闭的容器中会逐渐潮解,使用前应小心用水洗涤、过滤和烘干。
黑磷是磷的一种最稳定的变体,但因形成它所需的活化能很高,故在一般条件下,其它变体不能转变为黑磷。 只有在1215.9MPa(1200atm)压力下,将黄磷加热到473K方能转化为类似石墨的片状结构的黑磷.它能导电,故黑磷有“金属磷”之称。在三种同素异性体中,黑磷密度最大为2.7g·cm-3,不溶于有机溶剂,一般不容易发生化学反应。
膦是一种无色剧毒的、有类似大蒜臭味的气体。纯净的膦在空气中的着火点是423K,燃烧时生成磷酸。磷化氢在水中溶解度比NH3的溶解度小得多,它的水溶液的碱性也比氨水弱得多,碱常数约为10-26。膦具有较强的还原性,它能从Cu2+、Ag+、Hg2+等盐的溶液中还原出金属。
固体卤化鏻显然没有卤化铵稳定,PH4Cl、PH4Br、PH4I的分解温度分别为220K、27OK、335K、而同样顺序的卤化铵其分解温度为550~650K。在水溶液中不存在PH4+离子,它会立即分解。
一:卤化物的水解机理 本族卤化物(NF3除外)水解倾向从上至下减弱。AsCl3水解产物和PCl3相似,SbCl3和BiCl3水解生成难溶的碱式盐,NCl3的水解产物不同于PCl3和AsCl3。NCl3的水解按下式进行。
依次类推继续进行下列反应:
上述反应表明NCl3的水解是亲核体(如水中的氧)通过进攻Cl形成中间产物。亲核体之所以进攻Cl而不进攻N是由于:①N原子体积较小,不易受到亲核体的进攻而进攻Cl却较容易;②Cl在NCl3中有较大的电正性[按阿莱德-罗周(Allred-Rochow)的电负性计算换算为鲍林(Pauling)的电负性标度,XN=3.07,XCl=2.83],因此,Cl的亲电子能力比在正常情况下大,易接受亲核体进攻。
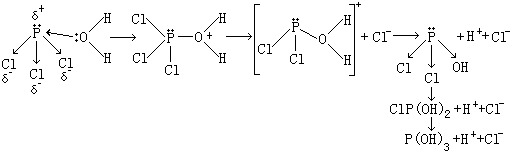
至于PCl3的水解则是亲核体通过进攻P形成中间产物:因为在PCl3中P有较大的电正性,同时过渡态中心原子P的价电子层又可以扩展,使其具有高的亲电性,这样中心原子P被亲核体进攻变得有利了。 二:三氯化磷 三氯化磷是无色液体,极易水解,在潮湿空气中冒烟。PCl3能与卤素加合生成五卤化磷。在较高温度或有催化剂存在时,可以与氧或硫反应生成三氯氧磷或三氯硫磷。
PCl3 + 3H2O
2PCl3 + O2
三:五氯化磷
PCl5与PCl3相同,易于水解,但水量不足时,则部分水解生成三氯氧磷和氯化氢。 当加热PCl5到573K时, 则完全分解:
PCl5
一:三氧化二磷
单质磷在氧中不完全燃烧的产物即为三氧化二磷。P4O6是有滑腻感的白色吸湿性蜡状固体(熔点297K,沸点447K),有很强的毒性,可溶于苯、二硫化碳和氯仿等非极性溶剂中。P4O6是亚磷酸的酸酐,但只有和冷水或碱溶液反应时才缓慢地生成亚磷酸或亚磷酸盐。在热水中它发生强烈的歧化反应。 二: 五氧化二磷 单质磷在充足的氧中燃烧的产物即为五氧化二磷。P4O10是白色雪状固体,易升华(632K),在加压下加热到较高温度,晶体就转化为无定形玻璃状体,在839K熔化。P4O10是磷酸的酸酐,它与水反应视水的用量多寡,P-O-P键将有不同程度断开,生成不同组分的酸。
由于P4O10对水有很强的亲和力,吸湿性强,因此,它常用作气体和液体的干燥剂。它甚至可以从许多化合物中夺取化合态的水,如使硫酸、硝酸脱水: 下表列出了几种实验室中常用的干燥剂的干燥效率。由表中数据可见P4O10的干燥效率最高.
由正磷酸经强热脱水后的产物叫做磷酸的缩合酸. 脱去1、2、(n-1)分子水后依次生成H4P2O7、H5P3O10、(HPO3)n,其反应过程如下:
上面各式表明焦磷酸、三磷酸和四偏磷酸等都是由若干个磷酸分子通过氧原子连接起来的多酸。但焦磷酸和三磷酸是链状结构,而四偏磷酸是环状结构。
一:正磷酸
纯净的磷酸为无色晶体,熔点315K,加热磷酸时逐渐脱水生成焦磷酸、偏磷酸,因此磷酸没有自身的沸点。磷酸能与水以任何比相混溶。市售磷酸是粘稠的浓溶液(质量百分含量约85%)。磷酸是一种无氧化性的不挥发的三元中强酸,在298K时,K1=7.5×10-3,K2=6.2×10-8,K3=2.2×10-13。
正磷酸能生成三个系列的盐,M3PO4,M2HPO4和MH2PO4(M是+I价金属离子)。所有的磷酸二氢盐都易溶于水,而磷酸一氢盐和正盐除了K+,Na+和NH4+离子的盐外,一般不溶于水。可溶性盐在水中都有不同程度的水解,使溶液显不同的pH值。
焦磷酸是无色玻璃状固体,易溶于水,在冷水中会慢慢地转变为正磷酸。焦磷酸水溶液的酸性强于正磷酸,它是一个四元酸(291K,K1>1.4×10-1、K2=3.2×10-2、K3=1.7×10-6、K4=6.O×10-9),能生成三种盐:二代、三代和四代盐。常见的焦磷酸盐有M2H2P2O7和M4P2O7两种类型。将磷酸氢二钠加热可得到Na4P2O7:
常见的偏磷酸有三偏磷酸和四偏磷酸。偏磷酸是硬而透明的玻璃状物质,易溶于水,在溶液中逐渐转变为正磷酸。将磷酸二氢钠加热,在673~773K间得到三聚偏磷酸盐: 它易溶于水,能与钙、镁等离子发生配位反应,常用作软水剂和锅炉、管道的去垢剂。
正磷酸、焦磷酸和偏磷酸可以用硝酸银加以鉴别。正磷酸与硝酸银产生黄色沉淀,焦磷酸和偏磷酸都产生白色沉淀,但偏磷酸能使蛋白沉淀。
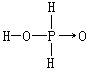
P4O6的水解或将含有PCl3的空气流从270~273K的水中通过都可得到亚磷酸。
它的电离常数K1=1.0×l0-2,K2=2.6×l0-7,能形成NaH2PO3和Na2HPO3两种类型的酸式盐。在亚磷酸分子中有一个P—H键容易被氧原子进攻,故具有还原性。亚磷酸及其盐都是强还原剂,能将Ag+,Cu2+等离子还原为金属.
次磷酸及其盐都是强还原剂,还原性比亚磷酸强,能使Ag(I),Cu(II),Hg(II)等还原,还可把冷的浓H2SO4还原为S.
次磷酸钠[KH2PO2或Ca(H2PO2)2均可]常用作化学镀镍中的还原剂。所谓化学镀镍是利用锌盐溶液在强还原剂的作用下,使镍离子还原为金属镍并在其它金属表面或塑料表面沉积形成牢固的镀层。Ni2+与H2PO2-的反应如下: |