|
钛金属的外型似钢,纯金属具有良好的可塑性,但当有杂质存在时变得脆而硬。在通常温度下,金属具有很好的抗腐蚀性,因为它们的表面容易形成致密的氧化膜。但在加热时,它能与O2、N2、H2、S和卤素等非金属作用。在室温时,它们与水、稀盐酸、稀硫酸和硝酸都不作用,但能被氢氟酸、磷酸、熔融碱侵蚀。钛能溶于热浓盐酸中,得到TiCl3。
2Ti + 6HCl 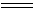 2TiCl3 + 3H2↑ 2TiCl3 + 3H2↑
金属钛更易溶于HF+HCl(H2SO4)中,这时除浓酸与金属反应外,还利用F-与Ti4+的配位反应,促进钛的溶解:
Ti
+ 6HF 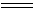 TiF62- + 2H+ + 2H2↑ TiF62- + 2H+ + 2H2↑

在钛的化合物中,以+Ⅳ氧化态最稳定,在强还原剂的作用下,也可呈现+Ⅲ和+Ⅱ氧化态,但不稳定。
二氧化钛为白色粉末,不溶于水也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。
TiO2 + 6HF 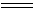 H2[TiF6] + 2H2O H2[TiF6] + 2H2O
TiO2 + 2H2SO4 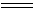 Ti(SO4)2 +
2H2O
Ti(SO4)2 +
2H2O
TiO2 + H2SO4 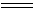 TiOSO4 + H2O
TiOSO4 + H2O
实际上不能从溶液中析出Ti(SO4)2而是析出TiOSO4·H2O的白色粉末。这是因为Ti4+离子的电荷半径比值(即Z/r)大,容易与水反应,经水解而得到TiO2+离子,钛酰离子常成为链状聚合形式的离子(TiO)n2n+,如固态的TiOSO4·H2O中的钛酰离子就是这样。也就是说,在水溶液中不存在Ti4+离子,而只能得到TiO2+离子。

二氧化钛的水合物—TiO2·xH2O(也常写成H4TiO4或Ti(OH)4)称为钛酸。这种水合物既溶于酸也溶于碱而具有两性。与强碱反应得金属偏钛酸盐的水合物。无水偏钛酸盐如偏钛酸钡可由TiO2与BaCO3一起熔融(加入BaCl2或Na2CO3作助熔剂)而制得。
TiO2 +
BaCO3 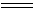 BaTiO3 + CO2↑ BaTiO3 + CO2↑
人工制得的BaTiO3具有高的介电常数,由它制成的电容器具有较大的容量。
由二氧化钛溶于热的浓硫酸中可得到钛的硫酸盐。钛的硫酸盐与碱金属硫酸盐可生成M2[Ti(SO4)3]配合物,如K2[Ti(SO4)3]。
Ti(SO4)2 + K2SO4 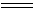 K2[Ti(SO4)3]
K2[Ti(SO4)3]
在中等酸度的钛(Ⅳ)盐溶液中,加入H2O2,可生成较稳定的桔黄色的[Ti(H2O2)]2+。
TiO22+
+ H2O2 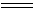 [TiO(H2O2)]2+
[TiO(H2O2)]2+
利用此反应可进行钛的定性检验和比色分析。

钛的卤化物中最重要的是四氯化钛。它是无色液体,熔点为250K,沸点409K。它有刺激性气味,在水中或潮湿空气中都极易水解。因此,四氯化钛暴露在空气中会发烟。
TiCl4 +
3H2O 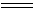 H2TiO3 + 4HCl H2TiO3 + 4HCl
如果溶液有一定量的盐酸时,TiCl4仅发生部分水解,生成氯化钛酰TiOCl2。
钛(Ⅳ)的卤化物易形成配合物。如钛的卤化物与相应的卤化氢或它们的盐生成M2[TiX6]配合物。
TiCl4 +
2HCl(浓) 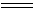 H2[TiCl6] H2[TiCl6]
这种配酸只存在于溶液中,若往此溶液中加入NH4+离子,则可析出黄色的(NH4)2[TiCl6]晶体。

用锌处理钛(Ⅳ)盐的盐酸溶液,或将钛溶于浓盐酸中得到三氯化钛的水溶液,浓缩后,可以析出紫色的六水合三氯化钛TiCl3.6H2O晶体,其化学式应为[Ti(H2O)6]Cl3。
2TiCl4 + Zn 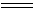 2TiCl3
+ ZnCl2
2TiCl3
+ ZnCl2
2Ti + 6HCl 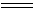 2TiCl3 + 3H2
2TiCl3 + 3H2
如果在此溶液中加入乙醚,并通入氯化氢至饱和,可以由绿色的乙醚溶液中得到绿色的六水合三氯化钛晶体,紫色的和绿色的TiCl3.6H2O是不同的异构体。绿色的TiCl3.6H2O的组成可能[Ti(H2O)5]Cl3.H2O。
如将干燥的气态四氯化钛和过量的氢气在灼热管中还原可以得到紫色粉末状三氯化钛。
2TiCl4 + H2  2TiCl3
+ 2HCl
2TiCl3
+ 2HCl
三氯化钛在高于723K时,于真空中歧化为二氯化钛和四氯化钛。在更高的温度下,不挥发的TiCl2会进一步歧化。
2TiCl3(s)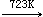 TiCl4(g)
+ TiCl2(s) TiCl4(g)
+ TiCl2(s)
2TiCl2(s)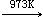 Ti(s)
+ TiCl4(g) Ti(s)
+ TiCl4(g)

Ti(Ⅲ)离子是一个强还原剂(比Sn2+稍强)。
TiO2+ + 2H+ + e-
→ Ti3+ + H2O
ψθ=0.1V
钛(Ⅲ)盐非常容易被空气或水所氧化。
利用钛(Ⅲ)离子的还原性,可以测定溶液中钛的含量。例如,在Ti(Ⅳ)的硫酸溶液中,在隔绝空气的情况下,金属铝片可使溶液中的Ti(Ⅳ)还原为Ti3+离子。
6Ti(SO4)2 + 2Al
 3Ti2(SO4)3
+ Al2(SO4)3 3Ti2(SO4)3
+ Al2(SO4)3
溶液中的Ti3+可以用Fe3+为氧化剂进行滴定,其反应为:
Ti2(SO4)3
+ Fe2(SO4)3 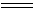 2Ti(SO4)2
+ 2FeSO4
2Ti(SO4)2
+ 2FeSO4
溶液中加入KSCN为指示剂。当加入稍过量的Fe3+离子时,Fe3+离子即与SCN-离子生成红色的K3[Fe(SCN)6]表示反应已达终点。在有机化学中还可用以测定硝基化合物的含量,因为它的将硝基化合物还原为胺。
RNO2 + 4Ti3+ + 2H2O
→ RNH2 + 4TiO2+ + 2H+
更强的还原剂可以将Ti3+还原成Ti2+离子,但Ti2+离子更不稳定。

|