|
由于硅易与氧结合,自然界中没有游离态的硅。大部分坚硬的岩石是由硅的含氧化合物构成的。在自然界里,二氧化硅的存在形式不下二百多种,天然的硅酸盐约有一千多种,它们组成复杂,可用通式aMxOy·SiO2·cH2O表示。下表列出一些常见的硅酸盐矿物组成。
|
石棉
沸石
云母
滑石
高岭土
石榴石
长石 |
CaMg3(SiO3)4
Na2(Al2Si3O10).2H2O
KAl2(AlSi3O10)(OH)2
Mg3(Si4O10)(OH)2
Al2Si2O5(OH)4
Ca3Al2(SiO4)3
KAlSi3O8 |
CaO.3MgO.4SiO2
Na2O.Al2O3.3SiO2.2H2O
K2O.3Al2O3.6SiO2.2H2O
3MgO.4SiO2.H2O
Al2O3.3SiO2.2H2O(粘土的主要组分)
3CaO.Al2O3.3SiO2
K2O.Al2O3.6SiO2 |
硅原子的价电子构型与碳原子的相似,它可形成sp3d2、sp3和sp2等杂化类型,并以形成共价化合物为特征。不过它的原子半径比碳的大,且有3d轨道,因而情况又与碳原子有所不同:
(1)它的最高配位数是6,常见的为4。
(2)它不能形成pπ-pπ键,无多重键,而倾向于以较多的σ单键形成聚合体,例如通过Si-O-Si链形成形形色色的SiO2聚合体和硅酸盐。

硅有两种晶型。无定形硅为深灰色粉末,晶形硅为银灰色,且具金属光泽,能导电,但导电率不及金属,且随温度的升高而增加。硅在化学性质方面主要表现为非金属性。象这类性质介于金属和非金属之间的元素称为“准金属”或“类金属”或“半金属”。准金属是制半导体的材料。 晶态硅具有金刚石那样的结构,所以它硬而脆(硬度为7.0)、熔点高,在常温下化学性质不活泼。无定形硅比晶态硅活泼。其主要化学性质如下:
(l)与非金属作用
Si在常温下只能与F2反应,生成SiF4(Si-F键的键能比
Si-Si,Si-O,Si-H的都大得多)。但在高温下能与其它卤素和一些非金属单质反应。在673K与Cl2反应,得到SiCl4;在873K与O2反应生成SiO2;1573K与N2反应得到Si3N3,2273K时与碳生成SiC。这些化合物均有广泛用途,如Si3N4,属强共价键合的物质,是最有实用价值的陶瓷材料。它耐高温,在高温下有较高强度;有优良的耐磨性能、机械性能和热的冲击性;它还具有优良的耐蠕变性,因此可用于做陶瓷引擎,用于汽车和飞机上。 (2)与酸作用
Si在含氧酸中被钝化。在有氧化剂(HNO3、CrO3、KMnO4、H2O2等)存在的条件下,与HF酸反应。
3Si + 4HNO3 + 18HF  3H2SiF6 +
4NO↑+ 8H2O △rGθ=-2133kJ·mol-1
3H2SiF6 +
4NO↑+ 8H2O △rGθ=-2133kJ·mol-1 (3)与碱作用
无定形Si能猛烈地与强碱反应,放出H2。
Si + 2NaOH + H2O  Na2SiO3
+ 2H2↑
Na2SiO3
+ 2H2↑
(4)与金属作用
Si能与某些金属生成硅化物,如FeSi2,FeSi,Mo3Si等。 
硅与碳相似,有一系列氢化物,不过由于硅自相结合成链的能力比碳差,生成的氢化物要少得多。到目前为止,已制得的硅烷不到12种,其中较熟悉的有SiH4、Si2H6、Si3H8、Si4H10、Si5H12以及Si6H14等,即一硅烷到六硅烷,可以用通式SinH2n+2(7≥n≥1)来表示。硅烷的结构与烷烃相似。一硅烷又称为甲硅烷。
硅烷为无色无臭的气体(SiH4和Si2H6)或液体。它们能溶于有机溶剂,熔点,沸点都很低。化学性质比相应的烷烃活泼,表现在以下几方面:
(1)强还原性
硅烷能与O2或其它氧化剂猛烈反应。它们在空气中自燃,燃烧时放出大量的热,产物为SiO2。如:
SiH4 +
2O2  SiO2 +
2H2O △rHθ=-1430kJ.mol-1 SiO2 +
2H2O △rHθ=-1430kJ.mol-1
能与一般氧化剂反应。如:
SiH4 + 2KMnO4
 2MnO2↓+
K2SiO3 + H2 + H2O 2MnO2↓+
K2SiO3 + H2 + H2O
SiH4 + 8AgNO3
+ 2H2O  8Ag↓+
SiO2↓+ 8HNO3 8Ag↓+
SiO2↓+ 8HNO3
这二个反应可用于检验硅烷。
(2)与水作用
硅烷在纯水中不发生水解作用,但当水中有微量碱存在时,由于碱的催化作用,水解反应即激烈地进行。
SiH4 + (n+2)H2O  SiO2.nH2O↓+ 4H2
SiO2.nH2O↓+ 4H2
(3)热稳定性差
所有硅烷的热稳定性都很差,分子量大的稳定性更差。将高硅烷适当地加热,它们即分解为低硅烷。低硅烷(如SiH4)在温度高于73K即分解为单质硅和氢气。
SiH4  Si
+ 2H2
Si
+ 2H2
SiH4被大量地用于制高纯硅。硅的纯度超高,大规模集成电路的性能就越好。

硅的卤化物都是共价化合物,熔点、沸点都比较低,氟化物、氯化物的挥发性更大,易于用蒸馏的方法提纯它们,常被用作制备其它含硅化合物的原料。
这些卤化物同CX4相似,都是非极性分子,以碘化物的熔点、沸点最高,而氟化物最稳定。所不同的是硅的卤化物强烈地水解,它们在潮湿空气中发烟,如:
SiCl4(l) + 3H2O(l)  H2SiO3(s)
+ 4HCl(aq)
H2SiO3(s)
+ 4HCl(aq)
故SiCl4可作烟雾剂。但是CCl4不水解。这与Si有3d轨道,配位数为6,能同H2O配位,而碳原子不具备此条件有关。
由于同一原因,SiF4很容易与F-形成SiF62-配离子。
SiF4 +
2F-  SiF62- SiF62-
Si-F的键能(565kJ.mol-1)比C-F的键能(485kJ.mol-1)大,所以SiF4比CCl4稳定。CF4于1273K分解,而SiF4在此温度下不分解。 
当SiF4水解时,未水解的SiF4极易与水解产物HF配位形成氟硅酸H2SiF6
SiF4 + 2HF  H2SiF6
H2SiF6
现在还未制得游离的H2SiF6,只能得到含H2SiF6质量百分比为60%的溶液。它是一种强度相当于H2SO4的强酸,以SiF62-和H3O+离子形式存在于水溶液中。金属锂、钙等的氟硅酸盐溶于水;钠、钾、钡的氧硅酸盐难溶于水。用纯碱溶液吸收SiF4气体,可得到白色的氟硅酸钠Na2SiF6晶体。
3SiF4 + 2Na2CO3
+ 2H2O  2Na2SiF6↓+
H4SiO4 + 2CO2 2Na2SiF6↓+
H4SiO4 + 2CO2
生产磷肥时,利用此反应可除去有害的废气SiF4,同时得到很有用的副产物Na2SiF6。Na2SiF6可作农业杀虫剂,搪瓷乳白剂及木材防腐剂等。它有腐蚀性,灼热时将分解为NaF和SiF4。
SiF4与碱金属氟化物反应,也可以得到氟硅酸盐。
SiF4 + 2KF  K2SiF6
K2SiF6 K2SiF6用于制太阳能级的纯硅(含量99.97%)。 
一:一氧化硅 SiO是白色的晶体,不稳定,只在高温下存在。它可由Si与SiO2在高温下反应制得:
Si(s) + SiO2(s)
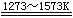 2SiO(s) 2SiO(s)
二:二氧化硅
因SiO2为原子晶体,且Si-O的键能很高,所以石英的硬度大,熔点高。将石英在1873K熔融,冷却时,它不再成为晶体,只是缓慢地硬化,成为石英玻璃,这实际上是一种过冷液体。无论是熔融的SiO2或是石英玻璃,它们仍然由SiO4四面体组成,只不过排列不象在石英晶体中那么整齐。
二氧化硅的化学性质不活泼,在高温下也不能被H2还原,只能为镁、铝或硼所还原。
SiO2 + 2Mg  2MgO
+ Si
2MgO
+ Si
除F2和HF以外,它不与其它卤素和酸类作用。它与HF水溶液反应的产物也是氟酸。SiO2为酸性氧化物,能与热的浓碱或熔融的碱或碳酸钠反应,得到硅酸盐。
SiO2 + 2Na0H  Na2Si03
+ H2O
Na2Si03
+ H2O
SiO2 + Na2CO3
 Na2SiO3
+ CO2↑ Na2SiO3
+ CO2↑
玻璃含有SiO2,所以玻璃能被碱腐蚀。 
一:
硅酸
硅酸为组成复杂的白色固体,通常用化学式H2SiO3表示。SiO2为此酸的酸酐,但是SiO2不溶于水,所以不能用SiO2与水直接反应得到H2SiO3,而只能用可溶性硅酸盐与酸反应制得,反应的实际过程很复杂。反应式一般写为:
SiO44- + 4H+  H4SiO4↓
H4SiO4↓
H4SiO4叫做正硅酸,它是个原酸,经过脱水可得到一系列酸,包括偏硅酸和多硅酸。产物的组成随形成条件不同而不同,常以通式xSiO2.yH2O表示。如:
偏硅酸 H2SiO3
x=1,y=1
二硅酸 H6Si2O7
x=2,y=3
三硅酸 H4Si3O8
x=3,y=2
二偏硅酸 H2Si2O5
x=2,y=1
因为在各种硅酸中以偏硅酸的组成最简单,所以常用H2SiO3式子代表硅酸。硅酸是一种二元弱酸,K1=2×10-10,K2=1×10-12。 H4SiO4在水中的溶解度不大,但生成后并不立即沉淀下来,因为开始形成的单分子硅酸能溶于水。当这些单分子硅酸逐渐缩合为多酸时,形成硅酸溶胶。在此溶胶中加电解质,或者在适当浓度的硅酸盐溶液中加酸,则得到半凝固状态、软而透明且有弹性的硅酸凝胶①(在多酸骨架里包含有大量水)。将硅酸凝胶充分洗涤以除去可溶性盐类,干燥脱水后即成为多孔性固体,称为硅胶。它是很好的干燥剂、吸附剂以及催化剂载体,对H2O、BCl3及PCl5等极性物质都有较强的吸附作用。
二: 硅酸盐
除了碱金属以外,其它金属的硅酸盐都不溶于水。硅酸钠是最常见的可溶性硅酸盐,可由石英砂与烧碱或纯碱反应而制得。
硅酸钠水解使溶液显强碱性,水解产物为二硅酸盐或多硅酸盐:
Na2SiO3 +
2H2O 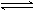 NaH3SiO4
+ NaOH NaH3SiO4
+ NaOH
2NaH3SiO4 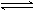 Na2H4Si2O7
+ H2O
Na2H4Si2O7
+ H2O
(也有将水解反应式写为:2Na2SiO3 + H2O
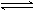 Na2Si2O5
+ 2NaOH) Na2Si2O5
+ 2NaOH)
工业上制多硅酸钠的方法是将石英砂、硫酸钠和煤粉混合后放在反射炉内进行反应,温度为1373~1623K。一小时以后,将产物冷却,即得玻璃块状物。这产物常因含有铁盐等杂质而呈灰色或绿色。用水蒸气处理使之溶解成为粘稠液体,成品俗称“水玻璃”,又名“泡花碱”。它是多种多硅酸盐的混合物,其化学组成为
Na2O.nSiO2。水玻璃的用途很广,建筑工业及造纸工业用它作粘合剂。木材或织物用水玻璃浸泡以后既可以防腐又可以防火。浸过水玻璃的鲜蛋可以长期保存。水玻璃还用作软水剂、洗涤剂和制肥皂的填料。它也是制硅胶和分子筛的原料。 
地壳的95%为硅酸盐矿。陨石和月球岩石的主要成分也是硅酸盐。最重要的天然硅酸盐是铝硅酸盐,其中丰度大的是长石。
硅酸盐矿的复杂性在其阴离子,而阴离子的基本结构单元是SiO4四面体。由此四面体组成的阴离子,除了简单的单个SiO44-和二硅酸阴离子Si2O76-以外,还有由多个SiO4四面体通过顶角上的一个或两个或三个、四个氧原子连接而成的环状、链状、片状或三向网格结构的复杂阴离子。这些阴离子借金属离子结合成为各种硅酸盐(见下表)。
| SiO4四面体组合形式 |
阴 离 子 |
例
子 |
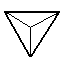 |
SiO44-(正硅酸盐) |
橄榄石(Mg,Fe)2SiO4,锆石ZrSiO4 |
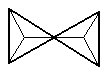 |
Si2O76-(二硅酸盐) |
硅铅矿Pb3Si2O7 |
 |
[SinO3n]2n-(环状) |
绿柱石Be3Al2[Si6O18] |
 |
[SiO3]n2n-(单链) |
链与链借金属离子连接成纤维结构如石棉CaMg3[SiO3]4 |
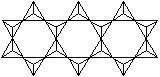 |
[Si4O11]n6n-(双链) |
链与链借金属离子连接成纤维结构如透闪石Ca3Mg5[Si8O22](OH)2 |
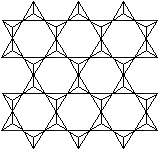 |
[Si4O10]n4n- |
金属离子在层与层之间如滑石Mg3[Si4O10](OH)2,白云母KAl2[Si3O10](OH)2 |
| - |
(SiO2)n
[AlSi3O8]nn-
[Al2Si3O10]n4n- |
石英SiO2
钾长石K(AlSi3O8)
沸石Na2(Al2Si3O10)·2H2O |

|




