|
碳在同族元素中,由于它的原子半径最小,电负性最大,电离能也最高,又没有d轨道,所以它与本族其它元素之间的差异较大(p区第二周期的元素都有此特点)。这差异主要表现在: (l)它的最高配位数为4, (2)碳的成链能力最强; (3)不但碳原子间易形成多重键,而且能与其它元素如氮、氧、硫和磷形成多重键。
纯净的,单质状态的碳有三种同素异形体:金刚石、石墨和C60。 一:物理性质 1:金刚石 金刚石晶莹美丽,光彩夺目,是自然界最硬的矿石。 金刚石极硬(1000kg/mm2),熔点极高(>3828K),是所有单质中熔点最高的。金刚石不导电,化学性质不活泼(常态任何液体对它均无作用,KClO3和HNO3对它也无作用)。在空气中加热到1100K左右时能燃烧成CO2。
金刚石和石墨在一定条件下,可以互相转化。当金刚石隔绝空气,并加热到1273K时,就可以转化为石墨: 2:石墨 因石墨的层与层之间是以分子间力结合起来的,则容易沿着与层平行的方向滑动、裂开,所以石墨具有润滑性,也因此化学性质比金刚石活泼,能被氧化剂、浓HNO3和KClO3等氧化成石墨氧化物(黄绿色的片状固体)。 3:C60 C60是由60个碳原子组成的球形32面体,即由12个五边形和20个六边形组成,只有这样C60分子才不存在悬键。 在C60分子中,每个C原子以sp2杂化与相邻的三个C原子相连,剩余的未参与杂化的一个p轨道在C60球壳的外围和内腔形成大π键,从而具有芳香性。 二:化学性质 碳在常温下很稳定,除氟外,许多试剂都不与它作用。碳的活性随温度升高而迅速增大。在高温时,它非常活泼,任何碳单质都能在充足的空气中燃烧成CO2,空气不足时,则生成CO。
C + O2
C + O2 碳在高温下还可与氢,硫,硅,硼等化合。碳和钙,铁,铝或它们的氧化物共同强热时生成碳化物。如:
CaO + 3C 碳是工业上常用的还原剂,可以冶炼金属和制造水煤气.
3C + Fe2O3
C + ZnO
C(红热) + H2O(g) 单质碳不和一般酸,碱反应,但氧化性的浓酸可以使其氧化,如:
C + 4HNO3
C + 2H2SO4
碳有许多氧化物,已见报导的有CO、CO2、C3O2、C4O3、C5O2和C12O9,其中常见的是CO和CO2。
CO作为一种配体,能与一些有空轨道的金属原子或离子形成配合物。例如同VIB、ⅦB和Ⅷ族的过渡金属形成羰基配合物:Fe(CO)5、Ni(CO)4和Cr(CO)6等。
CO + 1/2O2
这些反应使水煤气成为合成甲醇和某些有机物的原料之一。
与卤素反应:CO与F2、Cl2、Br2反应可得到碳酰卤化物。如
因此也可以把CO看作是甲酸HCOOH的酸酐。甲酸脱水可以得到CO,
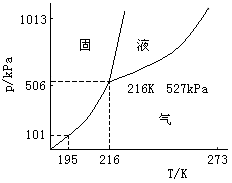
这是实验室利用甲酸或甲酸钠制取CO的反应。 二:二氧化碳 CO2在大气中约占0.03%,海洋中约占0.014%。它还存在于火山喷射气和某些泉水中。地面上的CO2主要来自煤、石油、天然气及其它含碳化合物的燃烧、碳酸钙矿石的分解、动物的呼吸以及发酵过程。地面上的植物和海洋中的浮游生物则将CO2转变为O2,一直维持着大气中O2与CO2的平衡。但是近几十年来随着全世界工业的高速发展和由此带来的海洋和大气的污染,同时森林又滥遭砍伐,这在很大程度上影响到生态平衡,使大气中的CO2越来越多,据估计每年约增加百万分之二到四。 大气中CO2含量的增多,是造成地球“温室效应”的主要原因。太阳光中绝大部分的紫外光被大气上空的臭氧层所吸收,其余部分的光进入大气。大气中的水气和CO2不吸收可见光,因此可见光可通过大气层而到达地球表面。与此同时,地球也会向外辐射能量,不过此能量是以红外光而辐射出去。水气和CO2能吸收红外光,这就使得地球应该失去的那部分能量被储存在大气层内,造成大气温度升高。有人估计,若大气温度升高2到3K,就会使世界气候发生剧变,同时会使地球两极的冰山发生部分融化,从而使海平面升高,甚至造成沿海一些城市被海水淹没的危险。 CO2分子没有极性,它很容易被液化,其临界温度为304K,在常温下,施加7.l×103kPa的压力即能液化。液态CO2的气化热很高,217K时为25.1kJ· mol-1。当部分液态CO2气化时,另一部分CO2即被冷却成为雪花状的固体。这固体俗称“干冰”,它是分子晶体。从相图(图13-20)可知,它的三相点高于大气压,所以在常压下于195K直接升华为气体,它是工业上广泛使用的致冷剂。
CO2不活泼,但在高温下,能与碳或活泼金属镁、钠等反应。
一: 碳酸 CO2溶于水中形成碳酸,298K时,1L水中溶1.45g(约0.033mol)。这时碳酸饱和溶液的浓度为0.04mol/L, pH为3.9, 它是二元酸,在水中存在下列平衡:
H2CO3
HCO3- 但并非全部溶解的CO2与H2O反应都生成H2CO3,实际上CO2首先生成CO2·6H2O, 然后约1~4%的CO2·6H2O转化为H2CO3。在298K时:
所以H2CO3的真正K1值应为2×10-4,称为H2CO3的有效电离常数。因H2CO3很不稳定,游离的H2CO3迄今尚未制得。 二. 碳酸盐
下面简介碳酸盐在水中的溶解性、水解性和热稳定性等性质。 所有碳酸氢盐都溶于水。正盐中只有铵盐和碱金属的盐溶于水。迄今为止,只知道碱金属(除锂外)和NH4+离子有固态的酸式盐,它们在水中的溶解度比相应的正盐的溶解度小,这同HCO3-离子在它们的晶体中通过氢键结合成链有关。
由于多数碳酸盐的溶解度小,自然界有许多碳酸盐矿石。大理石、石灰石、方解石以及珍珠、珊瑚、贝壳等的主要成分都是CaCO3。白云石、菱镁矿含有MgCO3。地表层中的碳酸盐矿石在CO2和水的长期侵蚀下可以部分地转变为Ca(HCO3)2而溶解。所以天然水中含有Ca(HCO3)2,它经过长期的自然分解或人工加热,又析出CaCO3。
在金属盐类(碱金属和NH4+盐除外)溶液中加可溶性碳酸盐,产物可能是碳酸盐,或碱式碳酸盐或氢氧化物。究竟是哪种产物,取决于反应物、生成物的性质和反应条件。如果金属离子不水解,将得到碳酸盐。如果金属离子的水解性极强,其氢氧化物的溶度积又小,如Al3+、Cr3+和Fe3+等,将得到氢氧化物。
许多金属元素的碳酸盐,如CaCO3、ZnCO3和PbCO3加热即分解为金属氧化物和CO2,而钠、钾、钡的碳酸盐在高温(熔融状态)也观察不到有明显的分解。一般来说,酸式碳酸盐的稳定性均比相应的正盐的稳定性差。碳酸盐受热分解的难易程度与阳离子的极化作用有关。阳离子对CO32-离子产生极化作用,使CO32-不稳定以致于分解。阳离子的极化作用越大,碳酸盐就越不稳定。H+(质子)的极化作用超过一般金属离子,所以有下列热稳定性顺序:
二硫化碳CS2为无色有毒的挥发性液体,熔点161.1K,沸点为226.9K,极易挥发,几乎不溶于水,但与乙醇,乙醚,四氯化碳等可以任意比例混溶。CS2可以用硫蒸气与炽热的煤反应得到。 二硫化碳具有较强的还原性,在空气中很容易着火,遇到强氧化剂则被氧化。这点和二氧化碳有明显的不同。
CS2 + 3O2
5CS2 + 4MnO4- + 12H+
碳的四种卤化物均已制得,它的主要物理性质见下表.
CF4对热和化学试剂都稳定。CCl4是四面体形的非极性分子,因分子量大,分子间作用力大,所以在常温下为液体,沸点为350K。由于其分子轨道全被电子填满,所以它不活泼,在常温下不为酸碱所分解,在高温和金属催化剂的作用下才水解。从水解反应自由能变数据看:
碳和电负性较小的元素形成的二元化合物称为碳化物。如CaC2(俗称电石)、Na2C2、WC、SiC等。碳化物有三种类型:离子型、间充型和共价型。它们都可以在2300K时将金属和它的氧化物同碳或一种烃在一起加热来制备。 又称为类盐型碳化物,主要由IA、ⅡA、ⅢA中的金属,IB、ⅡB(除汞外)及一些镧系金属和碳组成。金属和碳原子之间不存在典型的离子键,而具有共价倾向。习惯上称为离子型化合物。这类化合物有的易水解,生成碳氢化合物。根据生成碳氢化物的不同可分为炔型和甲烷型。常见炔型的有CaC2、BaC2、Mg2C3等。水解反应方程式如: 也称为金属型碳化物,主要由重过渡元素如Zr、Hf、Nb、Ta、Mo、W等形成MC形式的碳化物。形成这类化合物的金属原子的半径必须大于130Pm,只有这样,当这些原子紧密堆积时,才有可以接受C原子的空隙。这类碳化物特点是保留金属晶体结构,具有金属光泽和导电性,并比原金属具有更高的熔点(如TaC为4173K,Ta的熔点为3200K)和硬度(如WC的硬度为莫氏硬度9~10)。化学性质惰性,大量用来做耐高温、抗高强度的切削工具。轻过渡元素如CrMn、Fe、Co、Ni,它们的原子半径小于130pm,和碳形成的碳化物性质介于离子型和间充型之间,主要有Fe3C、Cr3C2、Co3C等。它们能被水和酸分解,生成碳氢化合物和氢气。这些碳化物结构是以碳原子链贯穿在变形的金属结构之中。 主要是电负性小的非金属形成的。最重要是碳化硅(SiC)和碳化硼(B4C)两种。碳化硅俗称金刚砂,其结构和金刚石相似,只是将金刚石中的半数C原子被Si原子替换,并间隔相连结。硬度仅次于金刚石,大约是莫氏硬度9度。主要用作磨料。碳化硼结构更复杂,非常坚硬(有人认为比金刚石还硬),可用为磨料(可研磨金刚石)和做辐射屏蔽物。 |
||||||||||||||||||||||||||||||||||