|
锕系元素又称5f过渡系,它是指周期表中原子序数从89~103的15种元素,它们是:锕(Ac),钍(Th),镤(Pa),铀(U),镎(Np),钚(Pu),镅(Am),锔(Cm),锫(Bk),镅(Cf),锿(Es),镄(Fm),钔(Md),锘(No),铑(Lr)。常以An表示锕系元素,它们都具有放射性。1789年德国克拉普罗特(Klaproth,M.H.1743~1817)从沥青铀矿中发现铀。它是被人们认识的第一种锕系元素。比铀原子序数小的锕、钍和镤也随后被陆续发现。在铀以后的元素称超铀元素,它们都是在1940年以后,用人工核反应合成的。极微量的镎和钚也存在于铀矿中。

锕系元素的价电子构型见下表所示。
|
原子序数
|
符号
|
元素
|
价电子构型
|
原子序数
|
符号
|
元素
|
价电子构型
|
|
89
|
Ac
|
锕
|
6d17s2
|
97
|
Bk
|
锫
|
5f9
7s2
|
|
90
|
Th
|
钍
|
6d27s2
|
98
|
Cf
|
锎
|
5f10
7s2
|
|
91
|
Pa
|
镤
|
5f26d17s2
|
99
|
Es
|
锿
|
(5f11
7s2)
|
|
92
|
U
|
铀
|
5f36d17s2
|
100
|
Fm
|
镄
|
(5f12
7s2)
|
|
93
|
Np
|
镎
|
5f46d17s2
|
101
|
Md
|
钔
|
(5f13
7s2)
|
|
94
|
Pu
|
钚
|
5f67s2
|
102
|
No
|
锘
|
(5f14
7s2)
|
|
95
|
Am
|
镅
|
5f77s2
|
103
|
Lr
|
铹
|
(5f146d17s2)
|
|
96
|
Cm
|
锔
|
5f76d17s2
|
- |
- |
- |
- |
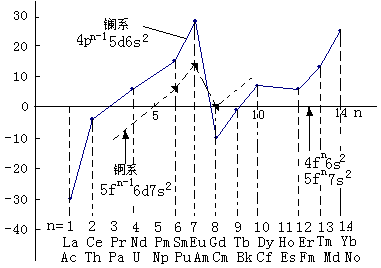
从表中可看出:锕系元素的价电子构型与镧系元素相似,出现两种构型,即[Rn]5fn7s2和[Rn]5fn-16d17s2(锕和钍无5f电子)。这两种电子构型之间的竞争,决定于二者的能量。对锕系元素,前一半元素中,Pu和Am的5fn-16d17s2的能量高于5fn7s2,故它们的电子构型取5fn7s2。Cm的情况与镧系的Gd相似。其余的均为5fn-16d17s2。锕系元素中的后一半与镧系元素非常相似,其电子构型为[Ru]5fn6s2。造成锕系元素电子层结构特殊的原因是5f和6d的能量相差较小(见图16-4),电子由5f跃迁至6d所需能量也较低,使得其前半部分的结构中具有强烈保持d电子的趋向。
|
|
|
图16-4
镧系和锕系原子的fns2fn-1d1s2的电子构型近似相对能量 |

锕系元素的已知氧化态见下表。
|
Ac
|
Th
|
Pa
|
U
|
Np
|
Pu
|
Am
|
Cm
|
Bk
|
Cf
|
Es
|
Fm
|
Md
|
No
|
Lr
|
|
- |
- |
- |
- |
- |
- |
(Ⅱ)
|
- |
- |
[Ⅱ]
|
[Ⅱ]
|
[Ⅱ]
|
[Ⅱ]
|
[Ⅱ]
|
- |
|
Ⅲ
|
(Ⅲ)
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
Ⅲ
|
|
- |
Ⅳ
|
Ⅳ
|
Ⅳ
|
Ⅳ
|
Ⅳ
|
Ⅳ
|
Ⅳ
|
Ⅳ
|
- |
- |
- |
- |
- |
- |
|
- |
- |
Ⅴ
|
Ⅴ
|
Ⅴ
|
Ⅴ
|
Ⅴ
|
- |
- |
- |
- |
- |
- |
- |
- |
|
- |
- |
- |
Ⅵ
|
Ⅵ
|
Ⅵ
|
Ⅵ
|
- |
- |
- |
- |
- |
- |
- |
- |
|
- |
- |
- |
- |
Ⅶ
|
Ⅶ
|
- |
- |
- |
- |
- |
- |
- |
- |
- |
划黑短线的数字表示最稳定的氧化态;( )表示只存在于固体中;[ ]表示只存在于溶液中
镧系元素无论是在水溶液或固体化合物中,+Ⅲ是正常氧化态;而锕系中前一部分元素(Th-Am)存在多种氧化态,Am以后的元素在水溶液中氧化态是+Ⅲ。
从图16-4中可以看出来,锕系元素中的前一半,5f→6d跃迁所需的能量比镧系元素4f→5d跃迁要少些,因此锕系的前一半元素提供更多的成键电子的倾向要大些,它们存在较高的价态是必然的结果。

锕系元素的离子半径列入下表中(配位数为6)。
|
- |
Ac
|
Th
|
Pa
|
U
|
Np
|
Pu
|
Am
|
Cm
|
Bk
|
|
rAn3+*/pm
|
126
|
- |
118
|
116.5
|
115
|
114
|
111.5
|
111
|
110
|
|
rAn4+/pm
|
- |
108
|
104
|
103
|
101
|
100
|
99
|
99
|
97
|
*An代表锕系元素
这些元素+3离子的最外层电子是已填满的6p层,随着原子序数增加,电子进入5f层,而5f电子不能完全屏蔽增加的核电荷,使有效核电荷增加,因而产生类似镧系收缩的锕系收缩现象。

锕系元素不同类型的离子在水溶液中的颜色,列入下表。
|
- |
An3+
|
An4+
|
AnO2+
|
AnO22+
|
|
Ac
|
无色
|
-
|
-
|
-
|
|
Th
|
-
|
无色
|
-
|
-
|
|
Pa
|
-
|
无色
|
-
|
-
|
|
U
|
红
|
绿
|
-
|
黄
|
|
Np
|
紫蓝
|
黄绿
|
绿
|
粉红
|
|
Pu
|
紫
|
黄褐
|
红紫
|
橙
|
|
Am
|
粉红
|
粉红
|
黄
|
棕
|
|
Cm
|
无色
|
-
|
-
|
-
|
除少数离子(Ac3+,Cm3+,Th4+,Pa4+和PaO2+)为无色外,其余离子都是显色的。镧系和锕系水合离子颜色的变化规律相似。Ce3+(4f1)和Pa4+(5f1),Gd3+(4f7)和Cm3+(5f7),La3+(4f0)和Ac3+(5f0)都是无色的。Nd3+(4f3)和U3+(5f3)显浅红色。

|
