|
镧系元素包括从57号的镧到71号的镥共15种元素,它们的化学性质十分相似。此外,第三副族镧之上的元素钇(Z=39)由于镧系收缩的影响,使得其原子半径、三价离子半径接近铽(Tb)和镝(Dy)。钇在矿物中与镧系共生,所以把钇和镧系元素合称为稀土元素。通常镧系元素用Ln表示,稀土元素用RE表示。
镧系元素原子的基态电子构型见下表。
镧系元素的电子构型有两种类型,即[Xe]4fn-15d16s2和[Xe]4fn6s2。某一元素的原子电子构型按照哪一类型排列,符合洪特规则的特例,即等价轨道全充满、半充满或全空的状态是比较稳定的。La的价电子构型为4f05d16s2(全空),Gd为4f75d16s2(半满),Lu为4f145d16s2(全满),因4f轨道已填满,余下一个电子填充在5d轨道上。
+Ⅲ氧化态是所有镧系元素在固体化合物,水溶液或其他溶剂中的特征氧化态。由于镧系金属在气态时,失去2个s电子和一个d电子或两个s电子和一个f电子所需的电离势比较低,所以一般能形成稳定的+Ⅲ氧化态。有些镧系元素表现出+Ⅱ或+Ⅳ氧化态,这些价态一般都没有+Ⅲ氧化态稳定。少数+Ⅳ氧化态的固体化合物已经制得,但是只有+Ⅳ氧化态的铈能存在于溶液中,是很强的氧化剂。虽然已经制得一些镧系元素+Ⅱ氧化态的固体化合物,但溶于水很快氧化为+Ⅲ氧化态。只有Sm2+、Eu2+和Yb2+离子能存在于溶液中,都是还原剂。
*表中离子表示已知一系列化合物,包括固体和水溶液中,X表示卤素原子 由表可见,当4f层保持或接近全空、半充满或全充满的状态时比较稳定,所以Ce,Pr,Tb,Dy常呈现出+Ⅳ氧化态,如Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8),而Sm,Eu,Tm,Yb则常呈现+Ⅱ氧化态,如Sm(4f6),Eu(4f7),Tm(4f13),Yb(4f14)。此外,Ce和Nd还存在+Ⅱ氧化态,Ce(4f2),Nd(4f4)。Nd还存在+Ⅳ氧化态Nd(4f2)。 当然氧化态的问题不能只从电子的构型来考虑,比如Sm,Tm有+Ⅱ氧化态(f6,f13)而没有+Ⅰ氧化态(f7,f14),还有其它如热力学和动力学因素(如电离势、升华能、水合能等)产生影响,在某些情况下,后者甚至是更重要的因素。
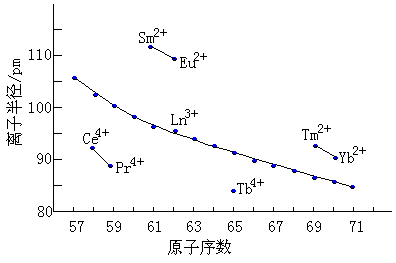
镧系元素的原子半径和离子半径见下表所示。
从表中的数据可以看出从Sc经Y到La,原子半径和三价离子半径逐渐增大,但从La到Lu则逐渐减小。这种镧系元素的原子半径和离子半径随原子序数的增加而逐渐减小的现象称为镧系收缩。
镧系元素中,原子核每增加一个质子,相应的有一个电子进入4f层,而4f电子对核的屏蔽不如内层电子,因而随着原子序数增加,有效核电荷增加,核对最外层电子的吸引增强,使原子半径、离子半径逐渐减少。
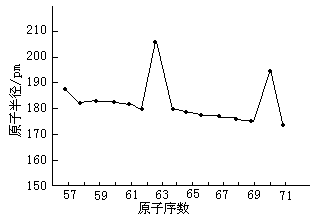
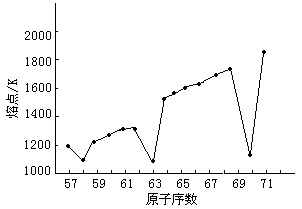
由图16-2可见,Eu和Yb的原子半径出现反常,比相邻元素的原子半径大得多。这是因为铕是半充满的4f7构型和镱是全充满的4f14构型的缘故。这种具备半充满和全充满的4f层是比较稳定的,对原子核有较大的屏蔽作用。在金属晶体中它们可能仅仅给出2个电子形成金属键,原子之间的结合力不像其他镧系元素那样强。所以金属铕和镱的密度较低,熔点也较低,升华能也比相邻的元素低(熔点见图16-3)。
镧系收缩在无机化学中是一个重要现象。镧系收缩的结果是什么呢? (1)由于镧系收缩,使钇成为稀土元素的成员,Y常与重稀土元素共生于矿物中。而钪的离子半径相差较远(Sc3+=73.2pm),故一般不与稀土矿共生。 (2)由于镧系收缩的存在,使ⅣB族中的Zr和Hf,在ⅤB族中的Nb和Ta,ⅥB族中的Mo和W,在原子半径和离子半径上较接近,化学性质也相似,造成这三对元素在分离上的困难。
一些镧系金属三价离子具有很漂亮的不同颜色。如果阴离子为无色,在结晶盐和水溶液中都保持Ln3+的特征颜色。下表为Ln3+的特征颜色。
Tb为略带淡粉红色。 从表中结果可见,若以Gd3+离子为中心,从Gd3+到La3+的颜色变化规律又在从Gd3+到Lu3+的过程中重演。这就是Ln3+离子颜色的周期性变化。
离子的颜色通常与未成对电子数有关。当Ln3+离子具有fn和f14-n电子构型时,它们的颜色是相同或相近的。颜色的产生是由电子吸收了特定波长的光,相当于一定的电子跃迁。Ln3+离子的颜色主要是由4f亚层中的f-f电子跃迁引起的。Ln3+可以吸收从紫外光、可见光到红外光区的各种波长的电磁辐射。
镧系金属的标准电极电势见下表。
从表中数据可以看到:镧系金属是一类较强的还原剂,其还原能力仅次于碱金属Li,Na,K和碱土金属Mg,Ca,Sr,Ba,而随着原子序数增加,其还原能力是逐渐减弱的。 表中数据还表明,Ln2+离子也是强还原剂。Ce4+是强氧化剂,能被水缓慢地还原。Pr4+是很强的氧化剂,Pr4+/Pr3+电对的电极电势计算值为+2.68V,这表明,Pr4+将会氧化水,所以Pr4+在水溶液中不能存在。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||