|
1.
物理性质
镧系元素是典型的金属元素,为银白色金属,比较软,有延展性。金属密度随着原子序数增加,从La(6.17g·cm-3)到Lu(99.84g·cm-3)逐渐增加。但Eu(95.26g·cm-3)和Yb(6.98g·cm-3)的密度较小,原因是由于其原子半径较大的缘故。
镧系元素的活泼性仅次于碱金属和碱土金属,
其电极电势为-2.25~-2.52V。金属活泼顺序:由Sc,Y,La递增;由La~Lu递减;即镧最活泼。
2.
化学性质
镧系金属与水都能直接作用,冷时缓慢,加热时反应迅速并放出氢气.它们在空气中慢慢被氧化并失去金属光泽。室温下轻稀土反应快,重稀土生成Ln2O3,Eu生成Eu(OH)2·H2O
2Ln + 6H2O 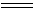 2Ln(OH)3
+ 3H2 2Ln(OH)3
+ 3H2
4Ln + 3O2 + 2xH2O
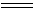 2Ln2O3·xH2O 2Ln2O3·xH2O
镧系金属都容易在空气中燃烧生成三氧化二物,只有铈生成CeO2:
4Ln + 3O2 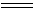 2Ln2O3(Ce除外) 2Ln2O3(Ce除外)
Ce + 2O2 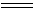 CeO2 CeO2
在较高温度时,镧系金属也能与卤素,C,N2,Si,P,S等非金属反应。
2Ln + 3X2 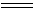 2LnX3(X2=F2-I2) 2LnX3(X2=F2-I2)
Ln + N2 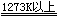 2LnN 2LnN
La + H2 → LaH2.87
镧系金属在室温下可与稀酸快速反应而放出氢气:
2Ln + 6H+ 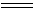 2Ln3+
+ 3H2 2Ln3+
+ 3H2

对所有镧系元素,三价是其特征氧化态。它们形成的氧化物为Ln2O3。
Ln2O3与碱土金属氧化物性质相似,可以从空气中吸收二氧化碳形成碳酸盐。Ln2O3能与水剧烈地化合,生成氢氧化物。它们与Al2O3不同,即使经过灼烧的Ln2O3也易溶于强酸中。生成Ln2O3的反应都是强的放热反应。例如△fHθ(La2O3)=-1790kJ.mol-1,△fHθ(Sm2O3)=-1810kJ.mol-1,而△fHθ(Al2O3)=-1645.7kJ.mol-1。

在Ln(Ⅲ)盐溶液中,加入NaOH溶液,可以得到Ln(OH)3的沉淀。大多数Ln(OH)3不溶于过量的碱中,但Yb(OH)3和Lu(OH)3除外,它们与浓碱液在高压釜中加热可转变为Na3Ln(OH)6。
氢氧化物不仅是水合氧化物,而且有确定的分子式Ln(OH)3。它们的溶解度很小,具体数据见下表。
Ln(OH)3的溶解度(c/10-6mol.L-1)
|
La(OH)3
7.8
|
Tb(OH)3
-
|
|
Ce(OH)3
4.8
|
Dy(OH)3
-
|
|
Pr(OH)3
5.4
|
Ho(OH)3
-
|
|
Nd(OH)3
2.7
|
Er(OH)3
0.8
|
|
Sm(OH)3
2.0
|
Tm(OH)3
0.6
|
|
Eu(OH)3
1.4
|
Yb(OH)3
0.5
|
|
Gd(OH)3
1.4
|
Lu(OH)3
0.5
|
因此,即使NH4Cl存在的情况下,往Ln(Ⅲ)盐溶液中加入氨水也可沉淀出Ln(OH)3,它们的溶解度从总的趋势来看是随着碱性减弱而减小的。
氢氧化物的碱性从Ln(OH)3到Lu(OH)3逐渐减弱,这是由于Ln3+半径逐渐减小的缘故。Ln(OH)3的碱性接近于碱土金属氢氧化物,不显两性,只能溶于酸而形成盐。而溶解度却比碱土金属氢氧化物小得多,Ln(OH)3的溶解度是随着温度升高而降低的,在这方面又和Ca(OH)2相似。

一:盐类通性
镧系元素的盐类多数都含有结晶水。轻镧系元素和重镧系元素的很多盐类在溶解度上存在很大差别(见下表),因而提供了镧系元素分组(铈组和钇组)方法。
|
阴离子
|
铈组(Z大约57-62)
|
钇组(Z=39和大约62-71*)
|
|
F-
|
不溶
|
不溶
|
|
Cl-,Br-,I-,ClO4-,BrO3-,NO3-,Ac-
|
易溶
|
易溶
|
|
OH-
|
不溶
|
不溶
|
|
SO42-(MⅠ复盐)
|
不溶于M2SO4溶液
|
溶于M2SO4溶液
|
|
NO3-(碱式)
|
中等溶解
|
微溶
|
|
PO42-
|
不溶
|
不溶
|
|
CO32-
|
不溶;不溶于过量CO32-溶液
|
不溶;溶于过量CO32-溶液
|
|
C2O42-
|
不溶;不溶于过量C2O42-溶液
|
不溶;溶于过量C2O42-溶液
|
*
也有将Z=63-71作为重镧系的。
从上表中可以看出钇组与铈组的区别是:钇组具有:
(1)复硫酸盐溶于M2SO4溶液;
(2)草酸盐溶于过量C2O42-溶液;
(3)碳酸盐溶于过量CO32-溶液;
(4)碱式硝酸盐微溶。
铈组则相反。根据溶解度的差别可将混合的镧系化合物很快地分离为两组—铈组和钇组。
二:卤化物
镧系元素的氟化物LnF3不溶于水,即使在含3mol·L-1HNO3的Ln3+盐溶液中加入氢氟酸或F-离子,也可得到氟化物的沉淀。这是镧系元素离子的特性检验方法。
氯化物易溶于水,在水溶液中结晶出水合物。在水溶液中,La—Nd常结晶出七水含氯化物,而Nd—Lu(包括Y)常结晶出六水合氯化物。无水氯化物不易从加热水合物得到,因为加热时生成氯氧化物LnOCl。制备无水氯化物最好是将氧化物在COCl2或CCl4蒸气中加热。也可加热氧化物与NH4Cl而制得。
Ln2O3 + 6NH4Cl  2LnCl3 + 3H2O + 6NH3
2LnCl3 + 3H2O + 6NH3
无水氯化物均为高熔点固体,易潮解,易溶于水,溶于醇,从熔融状态的电导率高说明它们为离子性。
溴化物与碘化物与氯化物相似。
三:硫酸盐
将镧系元素的氧化物或氢氧化物溶于硫酸中生成硫酸盐。由溶液中可以结晶出八水合物Ln2(SO4)3.8H2O。硫酸铈还有九水合物。无水硫酸盐可从水合物脱水而制得。
镧系元素的硫酸盐的溶解度随着温度升高而减小,它们能生成很多硫酸复盐,特别是钠盐,如Ln2(SO4)3.Na2SO4.2H2O利用此性质把镧系元素分离为铈组和钇组。
四:草酸盐
草酸盐[Ln2(C2O4)3]是最重要的镧系盐类之一。因为它们在酸性溶液中的难溶性,使镧系元素离子能以草酸盐形式析出而同其他许多金属离子分离开来。所以在重量法测定镧系元素和用各种方法使镧系元素分离时,总是使之先转为草酸盐,经过灼烧而得氧化物。
草酸盐沉淀的性质决定于生成时的条件。在硝酸溶液中,若主要离子是HC2O4-、NH4+离子,则得到复盐NH4Ln2(C2O4)3·yH2O(y=1或3)。在中性溶液中,用草酸铵作沉淀剂,则轻镧系得到正草酸盐,重镧系得到混合物。用0.1mol·L-1HNO3洗复盐可得到正草酸盐。
灼烧草酸盐时,经过脱水,生成碱式碳酸盐,最后生成氧化物。一般说,将草酸盐分解为氧化物,须在1073K加热30—40分钟。

铈、镨、钕、铽、镝都可以形成四价化合物。四价铈的化合物在水溶液中是稳定的。
四价铈的二元固体化合物有二氧化铈CeO2、水合二氧化铈CeO2·nH2O和氟化物CeF4。纯二氧化铈为白色。在空气中加热金属铈、Ce(OH)3、三价铈的含氧酸盐(如草酸盐、碳酸盐、硝酸盐)都可得到CeO2。二氧化铈是惰性物质,不与强酸或强碱作用,当有还原剂[如H2O2、Sn(Ⅱ)]存在时,可溶于酸并得到Ce(Ⅲ)溶液。在铈(Ⅳ)盐溶液中加入氢氧化钠,便析出胶状黄色沉淀,称水合二氧化铈CeO2·nH2O,它可重新溶于酸中。
一般铈(Ⅳ)盐不如铈(Ⅲ)盐稳定,在水溶液中易水解,以致铈(Ⅳ)盐在稀释时往往析出碱式盐。常见的铈盐有硫酸铈Ce(SO4)2.2H2O和硝酸铈Ce(NO3)4.3H2O,其中以硫酸铈最稳定。它在酸性溶液中是一个强氧化剂,标准电极电势如下:
Ce3+ + 2SO42- 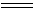 Ce(SO4)2
+ e- ψθ=+1.61V
Ce(SO4)2
+ e- ψθ=+1.61V
该反应的优点是在氧化还原过程中,Ce4+直接变为Ce3+而没有中间产物,反应快速,可用于定量分析工作中。

Sm、Eu、Yb在水溶液和固体化合物中均可形成二价离子,其中以Eu2+离子最稳定。可用Zn或Mg使Eu3+离子还原而得到Eu2+离子,但是制备
Sm2+和Yb2+离子则需用钠汞齐作还原剂。另外,用电解方法同样可将Eu3+离子还原为Eu2+离子。
镧系Lu2+离子的性质见下表,从标准电极电势可以看出在水溶液中还原能力的强弱。
|
离
子
|
颜
色
|
ψθ/V
Ln3++e-=Ln2+
|
离子半径
|
|
Sm2+
|
血红色
|
-1.15
|
111
|
|
Eu2+
|
无色
|
-0.429
|
109
|
|
Yb2+
|
黄色
|
-1.21
|
93
|
Yb2+溶液和Sm2+溶液能很快被水氧化。Yb2+和Sm2+盐的水合物能被本身的结晶水所氧化,但EuCl2·2H2O和其他Eu(Ⅱ)的盐却都是稳定的。
Ln2+与ⅡA族相似,特别与Ba2+类似。例如,硫酸盐难溶,而氢氧化物可溶,另外Eu2+的EDTA配合物的稳定常数是介于Ca2+和Sr2+的EDTA配合物的稳定常数之间,这也说明其相似性。

镧系元素的Ln3+离子,除水合离子外,它们的配合物为数不多,只有与强螯合剂形成的螯合物比较稳定。事实上镧系元素在配合物化学方面与Ca、Ba相似,而与d过渡元素差别较大。至少有以下几个原因降低了镧系元素离子的配位作用。
1.Ln3+离子的基态,4f轨道与正常价电子轨道5d6s6p相比居于内层,因此4f电子被有效地屏蔽起来,成为一种希有气体型结构的离子,所以f电子在通常情况下不参与成键,只有更高能量的轨道可以形成共价键。但是配位场稳定化能相当小,约4kJ·mol-1。
2.Ln3+离子比较大,而且又是希有气体型结构的离子,这方面与Ca、Ba相似。因此金属与配位体之间的作用靠静电吸引,具有相当的离子性质,而与配位体的共价作用减弱。d过渡元素则不同,具有很强的形成配合物的倾向。
3.水是强的配位体。在水介质中加入任何配位体与大量水竞争Ln3+离子的配位位置,通常是困难的。这样只有很强的配位体,特别是螯合剂才能与Ln3+形成稳定的配合物。
镧系金属离子属于硬酸,因此通常配位原子是氧和氮。典型的螯合物有:Ln3+与β-二酮类的乙酰丙酮基(以acac表示)生成螯合物Ln(acac)3和与乙二胺四乙酸(EDTA)生成的螯合物Ln(EDTA)-。在镧系元素的螯合物中,Ln3+的配位数往往超过6。例如在Y(acac)3.H2O中,配位数为7,7个氧原子包围着Y原子,分别排在三角柱体顶角加一个面心上。在La(acac)3.2H2O中,配位数为8,8个氧原子分别排在四方反锥体的角上。
这些配合物在碱性溶液中很稳定。它们的稳定性随着溶液的酸度增大而降低,随着镧系元素的原子序数增加而增大。这种稳定性变化规律的特征,已广泛应用于希土元素的分离(离子交换法和溶剂萃取法)和分析(配位滴定、分光光度滴定等)中。

|