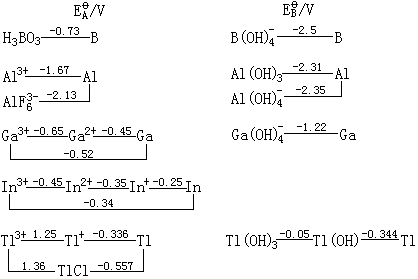|
第ⅢA族包括硼、铝、镓、铟和铊五种元素。其中除硼是非金属元素外,其余的都是金属元素,且其金属性随着原子序数的增加而增强。 硼族元素的一些基本性质列于下表中。
本族元素原子的价电子层结构为ns2np1,常见氧化态为+3和+1,随原子序数的递增,ns2电子对趋于稳定,特别是6s上的2个电子稳定性特别强。使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳定性依次增强,其还原性依次减弱。例如:Tl(Ⅲ)是很强的氧化剂,而Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。 +Ⅲ氧化态的硼族元素具有相当强的形成共价键的倾向。硼因原子半径较小,电负性较大,使其共价倾向最强,其它的硼族元素成键时表现为极性共价键。 硼族元素的价电子层有4条轨道(ns、npx、npy、npz),而只有3个价电子,这种价电子层中价轨道数超过价电子数的原子称为缺电子原子,中心原子价轨道数超过成键电子对数的化合物称为缺电子化合物。如本族+Ⅲ价单分子化合物BF3、AlCl3等。缺电子原子在形成共价键时,往往采用接受电子形成双聚分子或稳定化合物和形成多中心键(即较多中心原子靠较少电子结合起来的一种离域共价键)的方式来弥补成键电子的不足。
下面列出了硼族元素的标准电极电势图。
|