|
铝是银白色金属,熔点930K, 沸点2700K.具有良好的导电性和延展性,也是光和热的良好反射体.
铝最突出的化学性质是亲氧性,同时它又是典型的两性元素。
铝一接触空气或氧气,其表面就立即被一层致密的氧化膜所覆盖,这层膜可阻止内层的铝被氧化,它也不溶于水,所以铝在空气和水中都很稳定。
铝的亲氧性还可以从氧化铝非常高的生成焓看出来。
4Al + 3O2 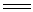 2Al2O3
△fHθ =-3339 kJ·mol-1 2Al2O3
△fHθ =-3339 kJ·mol-1 由于铝的亲氧性,它能从许多氧化物中夺取氧,故它是冶金上常用的还原剂。且常被用于冶炼铁,镍,铬,锰,钒等难熔金属,称为铝还原法。
Fe2O3 + 2Al 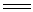 Al2O3
+ 2Fe
Al2O3
+ 2Fe
高纯度的铝(99.950%)不与一般酸作用,只溶于王水。普通的铝能溶于稀盐酸或稀硫酸,被冷的浓H2SO4或浓、稀HNO3所钝化。所以常用铝桶装运浓H2SO4、浓HNO3或某些化学试剂。
但是铝能同热的浓H2SO4反应。
2Al + 6H2SO4(浓)
 Al2(SO4)3
+ 3SO2↑+ 6H2O Al2(SO4)3
+ 3SO2↑+ 6H2O
铝比较易溶于强碱中。
2Al + 2NaOH + 6H2O 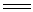 2Na[Al(OH)4]
+ 3H2↑
2Na[Al(OH)4]
+ 3H2↑

一:α-Al2O3
自然界存在的刚玉为α-Al2O3,它的晶体属于六方紧密堆积构型,6个氧原子围成一个八面体,在整个晶体中有2/3的八面体孔穴为Al原子所占据。由于这种紧密堆积结构,加上晶体中Al3+离子与O2-离子之间的吸引力强,晶格能大,所以α-Al2O3的熔点(2288±15K)和硬度(8.8)都很高。它不溶于水,也不溶于酸或碱,耐腐蚀且电绝缘性好,用作高硬度材料、研磨材料和耐火材料。天然的或人造刚玉由于含有不同杂质而有多种颜色。例如,合微量Cr(Ⅲ)的呈红色,称为红宝石;含有Fe(Ⅱ)、Fe(Ⅲ)或Ti(Ⅳ)的称为蓝宝石;含少量Fe3O4的称为刚玉粉。将任何一种水合氧化铝加热至1273K以上,都可以得到α-Al2O3。工业上用高温电炉或氢氧焰熔化氢氧化铝以制得人造刚玉。 二:γ-Al2O3 在温度为723K左右时,将Al(OH)3、偏氢氧化铝AlO(OH)或铝铵矾(NH4)2SO4·Al2(SO4)3·24H2O加热,使其分解,则得到γ-Al2O3。这种Al2O3不溶于水,但很易吸收水分,易溶于酸。把它强热至1273K,即可转变α-Al2O3。γ-Al2O3的粒子小,具有强的吸附能力和催化活性,所以又名活性氧化铝,可用作吸附剂和催化剂。 三:β-Al2O3
还有一种β-Al2O3,它有离子传导能力(允许Na+通过),以β-铝矾土为电解质制成钠-硫蓄电池。由于这种蓄电池单位重量的蓄电量大,能进行大电流放电,因而具有广阔的应用前景。这种电池负极为熔融钠,正极为多硫化钠(Na2Sx),电解质为β-铝矾土(钠离子导体)其电池反应为:
|
正极 2Na+ +
xS + 2e- |

|
Na2Sx |
|
负极 2Na |

|
2Na+ + 2e- |
| ------------------------------------------------- |
|
总反应: 2Na + xS |

|
Na2Sx
|
这种蓄电池使用温度范围可达620~680K,其蓄电量为铅蓄电池蓄电量的3~5倍。用β-Al2O3陶瓷做电解食盐水的隔膜生产烧碱,有产品纯度高,公害小的特点。

Al2O3的水合物一般都称为氢氧化铝。它可以由多种方法得到。加氨水或碱于铝盐溶液中,得一种白色无定形凝胶沉淀。它的含水量不定,组成也不均匀,统称为水合氧化铝。无定形水合氧化铝在溶液内静置即逐渐转变为结晶的偏氢氧化铝AlO(OH),温度越高,这种转变越快。若在铝盐中加弱酸盐碳酸钠或醋酸钠,加热,则有偏氢氧化铝与无定形水合氧化铝同时生成。只有在铝酸盐溶液中通入CO2,才能得到真正的氢氧化铝白色沉淀,称为正氢氧化铝。结晶的正氢氧化铝与无定形水合氧化铝不同,它难溶于酸,而且加热到373K也不脱水;在573K下,加热两小时,才能变为AlO(OH)。
氢氧化铝是典型的两性化合物。新鲜制备的氢氧化铝易溶于酸也易溶于碱:
3H2O +
Al3+ 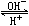 Al(OH)3 Al(OH)3
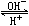 Al(OH)4- Al(OH)4-
例如: Al(OH)3 + 3HNO3 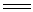 Al(NO3)3
+ 3H2O
Al(NO3)3
+ 3H2O
Al(OH)3 + KOH
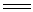 K[Al(OH)4] K[Al(OH)4]

一: 铝盐 用金属铝或氧化铝或氢氧化铝与酸反应即可得到铝盐。铝盐都含有Al3+离子,在水溶液中Al3+离子实际上以八面体的水合配离子[Al(H2O)6]3+而存在。它在水中水解,而使溶液显酸性。如
[Al(H2O)6]3+ + H2O
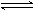 Al(H2O)5OH]2+
+ H3O+ Al(H2O)5OH]2+
+ H3O+
[Al(H2O)5OH]2+还将逐级水解。因为Al(OH)3是难溶的弱碱,一些弱酸(如H2CO3、H2S、HCN等)的铝盐在水中几乎完全或大部分水解,所以弱酸的铝盐如Al2S3及Al2(CO3)2等不能用湿法制得。
二: 铝酸盐 用金属铝或氧化铝或氢氧化铝与与碱反应即生成铝酸盐。铝酸盐中含Al(OH)4-[或Al(OH)4(H2O)2-]及Al(OH)63-等配离子,拉曼光谱已证实有Al(OH)4-离子存在。
铝酸盐水解使溶液显碱性,水解反应式如下:
Al(OH)4-
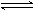 Al(OH)3 + OH- Al(OH)3 + OH-
在这溶液中通入CO2,将促进水解的进行而得到真正的氢氧化铝沉淀。工业上利用此反应从铝土矿制取纯Al(OH)3和Al2O3,方法是:先将铝土矿与烧碱共热,使矿石中的Al2O3转变为可溶性的偏铝酸钠而溶于水,然后通入CO2,即得到Al(OH)3沉淀,滤出沉淀,经过煅烧即成Al2O3。
Al2O3 +
2NaOH + 3H2O 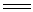 2NaAl(OH)4
2NaAl(OH)4
2NaAl(OH)4 + CO2
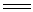 H2O
+ 2Al(OH)3↓+ Na2CO3 H2O
+ 2Al(OH)3↓+ Na2CO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
这样制得的Al2O3,可用于冶炼金属铝。
将上法得到的Al(OH)3和Na2CO3一同溶于氢氟酸,则得到电解法制铝所需要的助熔剂冰晶石Na3AlF6。
2Al(OH)3 + 12HF +
3Na2CO3 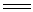 2Na3AlF6
+ 3CO2↑+ 9H2O
2Na3AlF6
+ 3CO2↑+ 9H2O

一:
铝的三卤化物 铝的四种卤化物AlX3都存在,它们的一些物理性质如下表所示.
|
名 称 |
AlF3 |
AlCl3 |
AlBr3 |
AlI3 |
|
状态(室温) |
无色晶体 |
无色晶体 |
无色晶体 |
棕色片状固体 |
|
熔点/(K) |
- |
463* |
371 |
464 |
|
沸点/(K) |
1564升华 |
456升华 |
536 |
633 |
*表示在250kPa下. 这些卤化物中, 仅AlF3为离子型化合物,
其余均为共价化合物。在通常条件下都是双聚分子,这是因为这些共价化合物都是缺电子的,为了解决这一矛盾,只能采用双聚形式。 二、三氯化铝
无水AlCl3在常温下是一种白色固体,遇水强烈水解,解离为Al(H2O)63+和Cl-离子。AlCl3还容易与电子对给予体形成配离子(如AlCl4-)和加合物(如AlCl3·
NH3)。这一性质使它成为有机合成中常用的催化剂。 三:
碱式氯化铝
以铝灰和盐酸为主要原料(还有其他方法和原料),在控制的条件下制得的碱式氯化铝是一种高效净水剂。它为无色或黄色树脂状固体,溶液无色或呈黄褐色,粗制品为灰黑色。它是由介于AlCl3和Al(OH)3之间一系列中间水解产物聚合而成的高分子化合物。它的组成式为[Al2(OH)nCl6-n]m,1≤n≤5,m≤10,是一种多羟基多核配合物,通过羟基架桥而聚合。因其式量较一般絮凝剂Al2(SO4)3、明矾或FeCl3大得多且有桥式结构,所以它有强的吸附能力。另一方面,它在水溶液中形成许多高价配阳离子,如[Al2(OH)2(H2O)8]4+和[Al3(OH)4(H2O)10]5+
…等。它能显著地降低水中泥土胶粒上的负电荷,所以它有高的凝聚效率和沉淀作用,能除去水中的铁、锰、氟、放射性污染物和重金属、泥沙、油脂、木质素以及印染废水中的流水性染料等,因而在水质处理方面大有取代Al2(SO4)3和FeCl3之势。

无水硫酸铝Al2(SO4)3为白色粉末。从水溶液中得到的为Al2(SO4)3.18H2O,它是无色针状结晶。将纯Al(OH)3溶于热的浓H2SO4或者用H2SO4直接处理铝土矿或粘土都可以制得Al2(SO4)3。
2Al(OH)3 + 3H2SO4
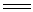 Al2(SO4)3
+ 6H2O Al2(SO4)3
+ 6H2O
Al2O3·2SiO2·2H2O(粘土)
+ 3H2SO4 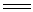 Al2(SO4)3
+ 2H4SiO4↓+ H2O
Al2(SO4)3
+ 2H4SiO4↓+ H2O
硫酸铝易与K+、Rb+、Cs+、NH4+和Ag+等的硫酸盐结合形成矾,其通式为MAl(SO4)2·12H2O(M表示一价金属离子)。在矾的分子结构中,有6个H2O分子与Al3+配位,形成Al(H2O)63+离子,余下的为晶格中的水分子,它们在Al(H2O)63+与阴离子(SO42-)之间形成氢键。硫酸铝钾KAl(SO4)2·12H2O对叫做铝钾矾,俗称明矾,它是无色晶体。Al2(SO4)3或明矾都易溶于水并且水解,它们的水解过程与AlCl3的相同,产物也是从一些碱式盐到Al(OH)3胶状沉淀。由于这些水解产物胶粒的吸附作用和Al3+的凝聚作用,Al2(SO4)3和明矾是人们早已广泛使用的净水剂(絮凝剂),但是处理水的效果不及碱式氯化铝好。铝离子能引起神经元退化,若人脑组织中铝离子浓度过大会出现早衰性痴呆症。Al2(SO4)3和明矾还用作媒染剂。织物用Al2(SO4)3的水溶液浸泡以后,再浸在Na2CO3或Ca(OH)2溶液中片刻,则所产生的胶状Al(OH)3沉积在纤维上,很容易吸附染料。此外,Al2(SO4)3还是泡沫灭火机中常用的药剂。

|