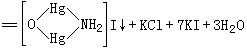|
汞是室温下唯一呈液态的金属。它有流动性。汞的化学性质不如Zn和Cd活泼。
1。与氧的反应
在加热至沸的条件下,Hg才缓慢地与氧作用生成HgO,但在773K以上又分解为Hg和O2。
|
2Hg + O2 |

|
2HgO |
汞与硫磺粉研磨即能形成硫化汞,这种反常的活泼性是由于汞是液态,研磨时汞与硫的接触面增大,反应就较容易进行。
2。与酸的反应
汞不与稀酸反应,只溶于热的浓硫酸或硝酸,在过量的硝酸中溶解汞产生硝酸汞(Ⅱ):
3Hg
+ 8HNO3 3Hg(NO3)2
+ 2NO + 4H2O 3Hg(NO3)2
+ 2NO + 4H2O
用过量的汞与冷的稀硝酸反应,得到的则是硝酸亚汞:
6Hg + 8HNO3 3Hg2(NO3)2
+ 2NO + 4H2O 3Hg2(NO3)2
+ 2NO + 4H2O
3。具有还原性
Hg与HgCl2一起研磨可制得Hg2Cl2
Hg + HgCl2  Hg2Cl2 Hg2Cl2
4。作“金属溶剂”
汞能溶解多种金属如Na,K,Ag,Zn,Sn,Pb等而形成“汞齐”(但铁不能与汞作用)。如钠汞齐常在有机合成中作还原剂,另外,利用汞能溶解Au,Ag的性质,在冶金中用汞齐法提取这些贵金属。

向汞盐溶液中加入碱,析出的不是Hg(OH)2,而是黄色的HgO,因Hg(OH)2不稳定,在室温下即立即分解,
Hg2+ + 2OH-  HgO↓+
H2O
HgO↓+
H2O
HgO为共价型化合物,不够稳定,加热到573K时,分解为汞与氧:
2HgO  2Hg + O2↑ 2Hg + O2↑
所以辰砂HgS在空气中焙烧时,可以不经过HgO而直接得到汞和二氧化硫。
HgO为碱性氧化物,只溶于酸,不溶于碱。

在Hg2+溶液中通入H2S或加入Na2S溶液,便得到黑色的HgS(Ksp=3.5×10-52)沉淀。
黑色HgS变体加热到659K转变为比较稳定的红色变体。硫化汞是溶解度最小的金属硫化物。在浓硝酸中也难溶解,但可溶于过量的浓Na2S溶液中,生成二硫合汞酸钠:
HgS(s) + Na2S(浓溶液)
 Na2[HgS2] Na2[HgS2]
实验室常用王水溶解HgS:
3HgS + 12HCl + 2HNO3  3H2[HgCl4]
+ 3S↓+ 2NO↑+ 4H2O
3H2[HgCl4]
+ 3S↓+ 2NO↑+ 4H2O

汞生成两种氯化物,即升汞HgCl2和甘汞Hg2Cl2。
将HgO溶于盐酸可以制得HgCl2。通常是将 HgSO4和NaCl的混合物加热而制得:
HgSO4 + NaCl  HgCl2
+ Na2SO4
HgCl2
+ Na2SO4
HgCl2为白色针状晶体,微溶于水,有剧毒,内服0.2-0.4g可致死,医院里用HgCl2稀溶液作手术刀剪的消毒剂。
氯化汞熔融时不导电,是共价型分子,熔点较低(543K),易升华,故俗名升汞。它在水溶液中很少离解,大量以HgCl2分子存在,离解常数很小:
HgCl2 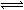 HgCl+
+ Cl- K1=3.2×10-7
HgCl+
+ Cl- K1=3.2×10-7
HgCl+ 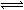 Hg+
+ Cl- K2=1.8×10-7
Hg+
+ Cl- K2=1.8×10-7
氯化汞遇到氨水即析出白色氯化氨基汞沉淀Hg(NH2)Cl:
HgCl + 2NH3  Hg(NH2)Cl↓+
NH4Cl
Hg(NH2)Cl↓+
NH4Cl
氯化汞在水中稍有水解,与上面的氨解反应是相似的:
HgCl + H2O  Hg(OH)Cl
+ HCl
Hg(OH)Cl
+ HCl
在酸性溶液中HgCl2是一个较强的氧化剂,同一些还原剂(如SnCl2)反应可被还原成Hg2Cl2或Hg。
HgCl2和SnCl2的反应可用以检验Hg2+或Sn2+离子。

在Hg2Cl2,Hg2(NO3)2等化合物中,汞的氧化态是+Ⅰ,汞的氧化态为+Ⅰ的化合物叫亚汞化合物。亚汞化合物中,汞总是以双聚体Hg22+的形式出现,结构为+Hg:Hg+,即两个Hg+以共价键结合,Hg22+中Hg+的共价数是2。有很多实验为这种结构提供证据。Hg+有一个成单电子应是顺磁性的,但所有的亚汞化合物都是反磁性,这表明不存在Hg+。X-射线衍射测定Hg2Cl2含有直线分子Cl-Hg-Hg-Cl,而没有单个离子。
亚汞盐多数是无色的,大多微溶于水,只有极少数盐如硝酸亚汞是易溶的。和Hg2+离子不同,亚汞离子Hg22+一般不易形成配离子。
在硝酸亚汞溶液中加入盐酸,就生成氯化亚汞沉淀:
Hg(NO3)2
+ 2HCl  Hg2Cl2↓+
2HNO3 Hg2Cl2↓+
2HNO3
氯化亚汞无毒,因味略甜,俗称甘汞,医药上作轻泻剂,化学上用以制造甘汞电极,它是不溶于水的白色粉末。在光的照射下,容易分解成汞和氯化汞:
Hg2Cl2 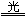 HgCl2 + Hg HgCl2 + Hg
所以应该把氯化亚汞贮存在棕色瓶中。

Hg22+和Hg2+在溶液中存在着下列平衡:
Hg + Hg2+
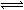 Hg22+ Hg22+
从下面的电势图可看出:
ψ右θ<ψ左θ ,上述反应的平衡常数:
表明溶液中Hg22+不易歧化。此反应常作为亚汞盐的制备,如把Hg(NO3)2溶液和Hg共同振荡,则生成Hg2(NO3)2:
Hg(NO3)2 + Hg  Hg2(NO3)2
Hg2(NO3)2
Hg2(NO3)2和Hg(NO3)2都溶于水,容易水解,配制溶液时需加入稀HNO3以抑制其水解:
Hg2(NO3)2 + H2O
 Hg2(OH)NO3(白色)↓+
H+ + NO3- Hg2(OH)NO3(白色)↓+
H+ + NO3-
但可逆反应Hg+Hg2+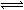 Hg22+的方向,在不同条件下是可以改变的。如果加入一种试剂同Hg2+离子形成沉淀或配合物从而大大降低Hg2+离子的浓度,就会加速Hg22+歧化反应的进行。例如,在Hg22+溶液中加入强碱或硫化氢时,就发生下列反应: Hg22+的方向,在不同条件下是可以改变的。如果加入一种试剂同Hg2+离子形成沉淀或配合物从而大大降低Hg2+离子的浓度,就会加速Hg22+歧化反应的进行。例如,在Hg22+溶液中加入强碱或硫化氢时,就发生下列反应:
Hg22+ + 2OH-
 Hg2(OH)2 Hg2(OH)2  Hg↓+ HgO↓+ H2O
Hg↓+ HgO↓+ H2O
Hg22+ + H2S
 Hg2S
+ 2H+ Hg2S
+ 2H+
└→HgS↓+ Hg↓
Hg22+ + CO32-  HgO↓ + Hg↓ + CO2↑
HgO↓ + Hg↓ + CO2↑
Hg22+ + 4I-  [HgI4]2- + Hg↓
[HgI4]2- + Hg↓
所以不存在亚汞的氧化物和硫化物。用氨水与Hg2Cl2反应,由于Hg2+离子同NH3生成了比Hg2Cl2溶解度更小的氨基化合物HgNH2Cl,使Hg2Cl2发生歧化反应:
Hg2Cl2(白色) + 2NH3
 HgNH2Cl(白色)↓+
Hg↓+ NH4Cl HgNH2Cl(白色)↓+
Hg↓+ NH4Cl
氯化氨基汞原是白色沉淀,金属汞为黑色分散的细珠,因此沉淀是灰色的。这个反应可以用来区分Hg22+和Hg2+。

由于Hg2+离子为18电子层结构,具有很强的极化力与明显的变形性,因此比相应主族元素有较强的形成配合物的倾向。Hg2+的配合物比Zn2+和Cd2+的稳定得多。而Hg22+离子形成配离子的倾向较小。
一:氨配合物
Hg2+和Hg22+均不与氨水形成氨配合物,而是生成白色沉淀(HgNH2Cl)和灰色沉淀(HgNH2Cl+Hg)。
二:氰配合物
Hg2+离子与氰化钾能生成很稳定的氰配合物:
Hg2+ + 4CN-  [Hg(CN)4]2-
K稳=3.3×1041
[Hg(CN)4]2-
K稳=3.3×1041
Hg2+离子主要形成配位数为2的直线型和配位数为4的四面体配合物。
三:其它配合物
Hg2+离子还可以与卤素离子和SCN-离子形成一系列配离子:
Hg2+
+ 4Cl-  [HgCl4]2-
K稳=1.6×1015
[HgCl4]2-
K稳=1.6×1015
Hg2+ + 4I-  [HgI4]2-
K稳=7.2×1029
[HgI4]2-
K稳=7.2×1029
Hg2+ + 4SCN-  [Hg(SCN)4]2-
K稳=7.7×1021
[Hg(SCN)4]2-
K稳=7.7×1021
配离子的组成同配位体的浓度有密切关系。在0.1molCl-离子溶液中,HgCl2、[HgCl3]-和[HgCl4]2-的浓度大致相等,在1molCl-离子的溶液中主要存在的是[HgCl4]2-离子,Hg2+与卤素离子形成配合物的倾向依Cl-Br-I顺序增强。
Hg2+与过量的KI反应,首先产生红色碘化汞沉淀,然后沉淀溶于过量的KI中,生成无色的碘配离子:
Hg2+ + 2I-  HgI2↓ 红色
HgI2↓ 红色
HgI2↓+ 2I-  [HgI4]2-
无色
[HgI4]2-
无色
K[HgI4]和KOH的混合溶液,称为奈斯勒试剂,如溶液中有微量NH4+离子存在时,滴入试剂立刻生成特殊的红棕色的碘化氨基.氧合二汞(Ⅱ)沉淀:
|
NH4Cl + 2K2[HgI4]
+ 4KOH |
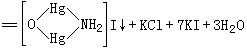 |
这个反应常用来鉴定NH4+或Hg2+离子。

|