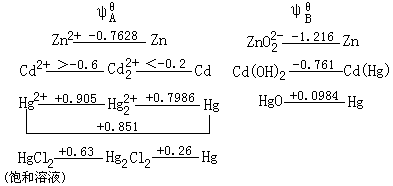|
一:锌族元素的基本性质 锌族元素包括锌、镉、汞三种元素,是周期系ⅡB族元素。它们的基本性质列于下表中。
二:锌族元素的通性
锌族元素的价电子构型为(n-1)d10ns2,
最外层只有二个s电子,但次外层具有18个电子,它们的特征氧化态为+Ⅱ,汞还有+Ⅰ的化合物. 三:锌族元素电势图 锌族元素的标准电势图如下:
一:物理性质 游离状态的锌、镉、汞都是银白色金属,其中锌略带蓝色。本族金属的物理性质列于下表。
锌族金属的特点主要表现为低熔点和低沸点,从上表可看出它们的熔点、沸点不仅低于铜族元素,而且低于碱土金属,并依Zn-Cd-Hg的顺序下降。汞是常温下唯一的液体金属,有流动性。 二:化学性质
锌族元素氧化物的性质见下表所示:
这些氧化物都几乎不溶于水。ZnO和CdO的生成热较大,较稳定,加热升华而不分解。HgO加热到573K时分解为汞与氧。 锌、镉、汞的氧化物都是共价型化合物,共价性依Zn、Cd、Hg的顺序而增强。
由于锌族的离子为18电子层结构,具有很强的极化力与明显的变形性,因此比相应主族元素有较强的形成配合物的倾向。
锌族元素的次外层为18电子结构对核电荷的屏蔽效应较小,因此,锌族元素原子最外层的一对s电子所受核的引力较强,原子半径和离子半径比相应钙、锶、钡为小,它们的电离势比碱土金属高。由于是18电子层结构,所以本族元素的离子具有很强的极化力和明显的变形性。结构方面的这些特点造成在性质上与碱土金属有许多不同。具体对比如下:
锌族金属的熔、沸点比碱土金属低,汞在常温下是液体。
锌族元素活泼性较碱土金属差,它们在常温下和在干燥的空气中不发生变化。都不能从水中置换出氢气,在稀盐酸中,锌易溶解,镉溶解较慢,汞完全不溶。
锌族元素在形成共价化合物和配离子的倾向上比碱土金属强得多。
锌的氢氧化物显两性,镉、汞的氢氧化物是弱碱性的。本族内从上到下,它们氢氧化物的碱性增强,而金属活泼性从上到下是减弱的。碱土金属的金属活泼性以及它们氢氧化物的碱性从上到下都是增强。钙、锶、钡的氢氧化物呈强碱性。 锌族元素的盐在溶液中都有一定程度的水解。而钙、锶、钡的强酸盐一般不水解。
在同一周期中,锌族元素在铜族元素之后。它们都具有充满d电子的次外层,因而性质上有很多相似之处;可是它们最外层电子数不同,因而又有些不同的地方。概括一下,主要有以下几点:
铜族元素为d电子刚填满(n-1)d轨道,s电子与d电子的电离势之差较小,故在一定条件下尚能失去1-2个d电子形成+Ⅱ、+Ⅲ等氧化态。而且仍能保持着过渡元素的同族从上到下高价稳定性增加的总趋势。至于锌族元素,因(n-1)d轨道已满,从满层中失去电子更加困难,s电子与d电子的电离势之差远比铜族为大,故通常只失去s电子而呈+Ⅱ氧化态。所以铜族呈现变价,而锌族不呈现变价。汞虽可表现为正一价,但实际上是以Hg22+离子的形式存在。
锌族金属的特点是低熔点和低沸点,不仅低于铜族金属而且低于碱土金属,并依Zn-Cd-Hg的顺序下降。 从标准电极电势φθ的数值和M(s)→M2+(aq)的总能量值的大小(见下表所示)可说明, 锌在此转化过程中所需能量低于铜, 所以锌比铜更活泼. 即锌族元素较铜族元素活泼。铜、银、金、汞等金属的标准电极电势都在氢之下,但锌镉则在氢之上。这两族元素金属活泼性次序为: Zn>Cd>H>Cu>Hg>Ag>Au
(4)氧化物或氢氧化物的碱性
锌族元素的氧化物或氢氧化物的碱性,比相应铜族元素的稍弱些。 锌族、铜族元素的离子都较易形成配合物。 |