|
一:碱土金属元素的基本性质
第ⅡA族碱土金属包括铍、镁、钙、锶、钡和镭六种元素。其元素基本性质见下表:
|
元
素
性 质 |
铍 |
镁 |
钙 |
锶 |
钡 |
|
符
号 |
Be |
Mg |
Ca |
Sr |
Ba |
|
原
子 序 数 |
4 |
12 |
20 |
38 |
56 |
| 原 子
量 |
9.012 |
24.31 |
40.08 |
87.62 |
137.3 |
|
价电子构型 |
2s2 |
3s2 |
4s2 |
5s2 |
6s2 |
|
主要氧化态 |
+Ⅱ |
+Ⅱ |
+Ⅱ |
+Ⅱ |
+Ⅱ |
|
原子半径(Pm) |
89 |
136 |
174 |
191 |
198 |
|
离子半径(Pm) |
31 |
65 |
99 |
113 |
135 |
|
第一电离势(kJ/mol) |
900 |
738 |
590 |
550 |
503 |
|
第二电离势(kJ/mol) |
1757 |
1451 |
1145 |
1064 |
965 |
|
第三电离势(kJ/mol) |
14849 |
7733 |
4912 |
4210 |
- |
|
电负性 |
1.57 |
1.31 |
1.00 |
0.95 |
0.89 |
|
标准电极电势(V)
M2+(aq)+2e-=M(s) |
-1.85 |
-2.36 |
-2.87 |
-2.89 |
-2.91 |
|
M2+(g)水合热(kJ/mol) |
2520 |
1960 |
1615 |
1475 |
1340 |
二:碱土金属元素的通性
1.
与碱金属比较
碱土金属原子的最外层电子结构是ns2,比相邻的碱金属原子多一个核电荷,原子核对最外层的s电子作用增强,因而碱土金属原子半径较同周期的碱金属为小,电离势要大些。这样碱土金属原子失去最外层的一个电子比相邻的碱金属原子困难,因此碱土金属的活泼性不如碱金属。但它们的电极电势仍为负值,所以仍是活泼性相当高的金属,也是强还原剂。碱土金属主要氧化数为+Ⅱ,它们在形成化合物时,与IA族元素一样,多形成离子型化合物,大多为无色。
碱土金属的熔点、沸点和硬度均较碱金属高,导电性却低于碱金属。碱土金属的物理性质变化不如碱金属那么有规律,这是由于碱土金属晶格类型不是完全相同的缘故。
2. 同族比较
碱土金属元素从上到下原子半径逐渐增大,电离势和电负性依次减小,它们的金属活泼性自上而下逐渐增强。

一:物理性质
碱土金属单质的物理性质见下表:
|
金
属
性 质 |
Be |
Mg |
Ca |
Sr |
Ba |
|
密
度(g/cm3) |
1.848 |
1.738 |
1.55 |
2.54 |
3.5 |
|
沸
点(K) |
3243 |
1363 |
1757 |
1657 |
1913 |
|
熔
点(K) |
1551 |
921.8 |
1112 |
1042 |
998 |
|
硬度(金刚石=10) |
4 |
2 |
1.5 |
1.8 |
3 |
|
导电性(Hg=1) |
5.2 |
21.4 |
20.8 |
4.2 |
- |
同其他金属一样,碱土金属单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,Ca、Sr、Ba较软,可以用刀子切割。由于碱土金属有二个价电子,原子半径又小于同周期碱金属元素,因此形成的金属键比碱金属的强,有较高的内聚力和高得多的熔点和沸点,它们的密度、硬度也比碱金属的大。由于本族金属的晶体结构不同(Be、Mg六方晶格,Ca、Sr立方晶格,Ba体心立方晶格),所以熔点变化没有很强的规律。
二:化学性质
1. 与非金属反应
碱土金属是活泼金属。同碱金属一样,它们能直接或间接与电负性较大的非金属元素,如卤素、硫、氧、磷、氮、氢等形成相应的化合物。
2. 与水反应
铍和镁与水作用时,表面生成致密的氧化物保护膜,因而对水稳定。钙、锶、钡容易与水反应生成氢氧化物和氢气。
3.
作还原剂
与碱金属一样,碱土金属也具有很强的还原性。但由于它们能与水反应,只能在干态下使用。例如在高温下Ca和Mg常作为还原剂。

一:普通氧化物
碱土金属氧化物的物理性质见下表。
|
氧 化 物 |
BeO |
MgO |
CaO |
SrO |
BaO |
|
熔 点(K) |
2803 |
3125 |
2887 |
2693 |
2191 |
|
硬度(金刚石=10) |
9 |
6.5 |
4.5 |
3.8 |
3.3 |
|
颜 色 |
白 |
白 |
白 |
白 |
白 |
碱土金属的氧化物除BeO外,均为NaCl型的离子化合物。由于碱土金属离子带有二个单位正电荷,离子半径较小,所以氧化物的熔点高,除BeO外,从MgO到BaO熔点依次下降。
经过煅烧的BeO和MgO难溶于水,而CaO、SrO、BaO同水猛烈反应,生成相应的氢氧化物并放出大量热:
MO(s) + H2O(l) 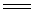 M(OH)2(s)
M=Ca、Sr、Ba
M(OH)2(s)
M=Ca、Sr、Ba
二:过氧化物
除Be外,其余元素均可生成过氧化物。其中BaO2是较重要的碱土金属过氧化物。过氧化物MO2与稀H2SO4反应可生成H2O2,其分解放出氧气。
MO2 + H2SO4(稀)
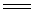 MSO4
+ H2O2 (M=Mg、Ca、Sr、Ba) MSO4
+ H2O2 (M=Mg、Ca、Sr、Ba)
三:超氧化物
除Be、Mg外,其余元素均可生成超氧化物。它们是在高压下,将氧气通过加热的过氧化物,可得到不纯的超氧化物MO4。其热稳定性依CaO4-SrO4-BaO4顺序而下降。

碱土金属氢氧化物的物理性质见下表:
|
氢氧化物 |
Be(OH)2 |
Mg(OH)2 |
Ca(OH)2 |
Sr(OH)2 |
Ba(OH)2 |
|
熔 点(K) |
脱水分解 |
脱水分解 |
脱水分解 |
脱水分解 |
脱水分解 |
|
水中溶解度(mol/L,298K) |
8×10-6 |
5×10-4 |
6.9×10-3 |
6.7×10-2 |
2×10-1 |
|
颜 色 |
白 |
白 |
白 |
白 |
白 |
|
碱 性 |
两性 |
中强 |
强 |
强 |
强 |
碱土金属氢氧化物在水中的溶解度和碱性从上到下依次递增。
比较ⅠA和ⅡA族氢氧化物的碱性,可总结为:同周期从左到右碱性减弱,同族从上到下碱性增强。

一:热稳定性:
碱土金属离子带两个正电荷,其半径较相应的碱金属小,所以离子之间的极化作用较强,导致其盐热稳定性较相应的碱金属盐类差,但在常温下均为热稳定性盐。
二:溶解性
碱土金属的盐比相应的碱金属盐溶解度小。它的氯化物、硝酸盐易溶于水,碳酸盐、草酸盐、磷酸盐都是难溶盐。硫酸盐、铬酸盐溶解度差异较大,BeSO4、BeCrO4易溶,而BaSO4、BaCrO4极难溶,从Be~Ba的硫酸盐、铬酸盐溶解度依次降低。它们的氟化物的溶解度从BeF2~BaF2依次升高。
碱土金属的碳酸盐、草酸盐、铬酸盐、磷酸盐均能溶于稀的强酸(如盐酸)溶液中。
三:结晶水
因为碱土金属离子比碱金属离子具有较小的半径和较大的电荷,所以碱土金属离子的水合焓约为碱金属离子的4-5倍。这样带有结晶水的碱土金属盐较多,例如:MgCl2·6H2O,CaCl2·6H2O,BaCl2·2H2O等。
四:焰色反应
Ca、Sr、Ba的挥发性化合物具有焰色反应,利用碱金属和Ca、Sr、Ba盐在灼热时产生的不同焰色的现象,可以制造各种焰火和信号弹。
|
离
子 |
Ca2+ |
Sr2+ |
Ba2+ |
|
焰
色 |
橙红 |
红 |
黄绿 |

碱土金属离子中,Be2+的半径最小,是较强的电子对接受体,能形成较多的配合物,如[BeF3]-、[BeF4]2-等。Be2+还可生成许多稳定的螯合物,如二(草酸根)合铍(Ⅱ)酸盐M2[Be(C2O4)2]。
钙、锶、钡的离子半径较大,生成配合物的能力较弱,Ba2+的配合物很少。钙除了能与氨形成不太稳定的氨合物CaCl2·NH3(1/8)外,还能与配位能力很强的螯合剂生成稳定的螯合物,最重要的是与乙二胺四乙酸根生成的螯合物[CaY]2-。

|