|
金是一种柔软的、黄色的金属,是所有元素中延展性最强的一个。1g金能抽成长达3km长的金丝,或压成厚约0.0001mm的金箔。这样薄的金箔看上去几乎透明,而略带绿色或蓝色。
金在化合物中表现为+3和+1两种氧化数,但以+3氧化数为最稳定。由金的标准电极电势图来看,在酸性溶液中,Au+容易歧化为Au3+和Au:
3Au+
歧化反应的K=1013,因此Au+在水溶液中不能存在,即使是溶解度很小的AuCl也要歧化。
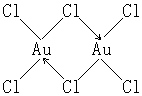
三氯化金AuCl3是一种褐红色的晶体,金与氯气在473K时作用可制得AuCl3晶体:
AuCl3在加热到523K时开始分解成AuCl和Cl2,在538K时开始升华但并不熔化,说明其共价性显著。
Au+的配合物[Au(CN)2]-很稳定,在水溶液中能存在,[Au(CN)2]-的K稳=2.0×1038
将AuCl3溶于盐酸中,可生成[AuCl4]-配阴离子溶液,蒸发此溶液,能够得到亮黄色的氯金(Ⅲ)酸水合晶体H[AuCl4]·4H2O。 |