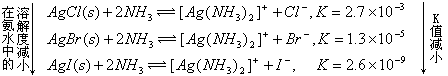|
纯银是一种美丽的银白色金属,具有很好的延展性,其导电性和导热性在所有金属中占第一位。银对自然光的反射性能最好(用于制镜工业),银离子能杀菌。 1. 与氧的反应 银的特征氧化数为+1,其化学活泼性比铜差。常温下,甚至加热时也不与水和空气中的氧作用,但久置空气中会变黑,失去银白色光泽。因银和空气中的H2S气体反应生成一层Ag2S的黑色薄膜的缘故。
4Ag + H2S + O2 2.
与卤素的反应
2Ag + F2
2Ag + Cl2
2Ag + Br2
2Ag + I2 银对硫有很强的亲合势,加热时与硫直接生成Ag2S:
2Ag + S 3. 与酸的反应 银不能与稀盐酸或稀硫酸反应置换出氢,但能溶解在硝酸或热的浓硫酸中:
2Ag
+ 2H2SO4(浓)
Ag + 2HNO3(浓)
在AgNO3溶液中加NaOH,反应首先析出白色AgOH,常温下AgOH极不稳定,立即脱水生成暗棕色Ag2O沉淀。Ag2O微溶于水,293K时,1L水能溶13mg,所以溶液微呈碱性。如果用溶于90%酒精的AgNO3溶液和KOH,在低于228K下,小心进行操作,可得到白色AgOH沉淀。
硝酸银熔点为481.5K,加热到713K时分解。如有微量的有机物存在或日光直接照射即逐渐分解。
2AgNO3 硝酸银晶体或它的溶液应该装在棕色玻璃瓶中。在室温下,许多有机物皆能将硝酸银还原成黑色银粉。
在硝酸溶液中加入卤化物,可以生成AgCl、AgBr、AgI沉淀。卤化银的颜色依Cl-Br-I的顺序依次加深。下表列出了卤化银的若干性质。
*:此处按ZnS型晶体结构计算,高压下按NaCl型计算,AgI键长为304pm。 AgCl、AgBr、AgI都不溶于稀硝酸。 AgCl、AgBr、AgI都具有感光性,可作感光材料,广泛用于照相技上。
Ag2S为不溶于水的黑色沉淀,其溶解度是Ag+盐中最小的,它的Ksp=2×10-49,但Ag2S能溶于热的浓HNO3或氰化钠溶液中:
3Ag2S + 8HNO3(浓)
Ag2S + 4CN-
Ag+离子的重要特征是容易形成配离子,如与NH3、S2O32-、CN-等形成稳定程度不同的配离子,下列的平衡常数表明了它们的稳定程度:
对于下列反应 对银氨配离子与AgX(X=卤素)按相同方法处理,得到下列反应的平衡常数K:
从上述平衡常数的大小可以看出:AgCl能较好地溶于浓氨水,而AgBr和AgI却难溶于氨水中。同理可说明AgBr易溶于Na2S2O3溶液中,而AgI易溶于KCN溶液中。 |