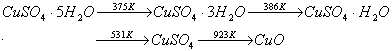|
纯铜是一种坚韧,柔软,富有延展性的紫红色有光泽的金属,1g铜可拉成3000m长的细丝,或压成10多平方米几乎透明的铜箔。纯铜的导电性和导热性很高,仅次于银,但铜比银要便宜得多。
1.
与氧的反应
铜是不太活泼的重金属,在常温下不与干燥空气中的氧化合,加热时能产生黑色的氧化铜。如果继续在很高温度下燃烧,就生成红色的Cu2O。
2Cu + O2  2CuO 2CuO
4Cu + O2  2Cu2O 2Cu2O
在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿,铜绿可防止金属进一步腐蚀,其组成是可变的。
2Cu + O2 + CO2
 Cu(OH)2.CuCO3 Cu(OH)2.CuCO3
2.
与卤素的反应
铜在常温下就能与卤素直接化合,加热时还能与硫直接化合生成CuS:
Cu + Cl2  CuCl2 CuCl2
Cu + S  CuS CuS
此外,铜还能与FeCl3作用,在电子工业中常用FeCl3溶液来刻蚀铜,以制造印刷线路。
Cu + 2FeCl3  2FeCl2 + CuCl2
2FeCl2 + CuCl2
3.
与酸的反应
在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶于这些稀酸中:
2Cu
+ 4HCl + O2  2CuCl2
+ 2H2O 2CuCl2
+ 2H2O
2Cu + 2H2SO4
+ O2  2CuSO4 +
2H2O
2CuSO4 +
2H2O
浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu=Cu+
+ e-的平衡向右移动:
2Cu + 8HCl(浓)  2H3[CuCl4]
+ H2↑
2H3[CuCl4]
+ H2↑
铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解:
Cu + 4HNO3(浓)
 Cu(NO3)2
+ 2NO2↑+ 2H2O Cu(NO3)2
+ 2NO2↑+ 2H2O
3Cu
+ 8HNO3(稀)  3Cu(NO3)2
+ 2NO↑+ 4H2O
3Cu(NO3)2
+ 2NO↑+ 4H2O
Cu + 2H2SO4(浓)
 CuSO4
+ SO2↑+ 2H2O CuSO4
+ SO2↑+ 2H2O

一:Cu2O
由于制备方法和条件的不同,Cu2O晶粒大小各异,而呈现多种颜色,如黄、桔黄、鲜红或深棕。
Cu2O溶于稀硫酸,立即发生歧化反应:
Cu2O
+ H2SO4  Cu2SO4
+ H2O
Cu2SO4
+ H2O
Cu2SO4  CuSO4
+ Cu
CuSO4
+ Cu
Cu2O对热十分稳定,在1058K时熔化而不分解,要加热到更高的温度时才分解。Cu2O不溶于水,具有半导体性质,常用它和铜装成亚铜整流器。在制造玻璃和搪瓷时,用作红色颜料。
Cu2O溶于氨水和氢卤酸中,分别形成稳定的无色配合物[Cu(NH3)2]+和[CuX2]-,[Cu(NH3)2]+很快被空气中的氧氧化成蓝色的[Cu(NH3)4]2+,利用这种性质可以除去气体中的氧:
Cu2O + 4NH3·H2O
 2[Cu(NH3)2]+
+ 2OH- + 3H2O 2[Cu(NH3)2]+
+ 2OH- + 3H2O
2[Cu(NH3)2]++4NH3·H2O+1/2O2 2[Cu(NH3)4]2++2OH-+3H2O 2[Cu(NH3)4]2++2OH-+3H2O
合成氨工业中常用醋酸二氨合铜(Ⅰ)[Cu(NH3)2]Ac溶液吸收对氨合成催化剂有毒的CO气体:
[Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO
[Cu(NH3)3]Ac·CO
这是一个放热和体积减少的反应,降温、加压有利于吸收CO。吸收CO以后的醋酸铜氨液,经减压和加热,又能将气体放出而再生,继续循环使用:
[Cu(NH3)3]Ac·CO  [Cu(NH3)2]Ac + CO↑+ NH3↑
[Cu(NH3)2]Ac + CO↑+ NH3↑
二:CuO
CuO是碱性氧化物,它不溶于水。加热时易被H2、C、CO、NH3等还原为铜:
3CuO + 2NH3  3Cu
+ 3H2O + N2
3Cu
+ 3H2O + N2
氧化铜对热是稳定的,只有超过1273K时,才会发生明显的分解反应:
2CuO  Cu2O + 1/2O2↑ Cu2O + 1/2O2↑
由此可看出:高温时Cu+比Cu2+更稳定,所以CuO在高温时可作有机物的氧化剂,使气态的有机物氧化成CO2和H2O。

在硫酸铜溶液中加入强碱,就生成淡蓝色的氢氧化铜沉淀:
CuSO4 + 2NaOH 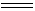 Cu(OH)2↓+
Na2SO4
Cu(OH)2↓+
Na2SO4
氢氧化铜(Ⅱ)的热稳定性较差,受热易分解,在溶液中加热至353K(80℃),Cu(OH)2即脱水变为黑褐色的CuO:
Cu(OH)2 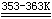 CuO↓+ H2O
CuO↓+ H2O
Cu(OH)2微显两性。所以既能溶于酸,又能溶于过量的浓碱溶液中:
Cu(OH)2 + H2SO4
 CuSO4
+ 2H2O
CuSO4
+ 2H2O
Cu(OH)2 + 2NaOH  Na2[Cu(OH)4]
Na2[Cu(OH)4]
四羟基合铜酸钠,蓝色

一: 卤化亚铜(CuX)
往硫酸铜溶液中逐滴加入KI溶液,可以看到生成白色的碘化亚铜沉淀和棕色的碘:
2Cu2+ + 4I-  2CuI↓+
I2
2CuI↓+
I2
由于CuI是沉淀,所以在碘离子存在时,Cu2+的氧化性大大增强,这时下列半电池反应的ψθ为:
Cu2+ + I- + e-
 CuI
ψθ=0.86V CuI
ψθ=0.86V
I2 + 2e-  2I- ψθ=0.536V
2I- ψθ=0.536V
所以Cu2+能氧化I-离子。由于这个反应能迅速定量地进行,反应析出的碘能用标准Na2S2O3溶液滴定,所以分析化学常用此法定量测定铜。在含有CuSO4和KI的热溶液中,再通入SO2,由于溶液中棕色的碘与SO2反应而褪色,白色CuI沉淀就看得更清楚,其反应为:
I2 + SO2 + 2H2O
 H2SO4
+ 2HI H2SO4
+ 2HI
CuCl2或CuBr2的热溶液与各种还原剂如SO2、SnCl2等反应可以得到白色CuCl或CuBr沉淀:
2CuCl2 + SO2 + 2H2O
 2CuCl↓+ H2SO4 + 2HCl 2CuCl↓+ H2SO4 + 2HCl
在热、浓盐酸中,用Cu将CuCl2还原,可以形成[CuCl2]-、[CuCl3]2-和[CuCl4]3-等配离子。
二:卤化铜(CuX2)
除碘化铜(Ⅱ)不存在外,其它卤化铜都可借氧化铜和氢卤酸反应来制备,例:
CuO + 2HCl  CuCl2 + H2O
CuCl2 + H2O
卤化铜的一些物理性质列于下表中。
|
性
质
|
CuF2
|
CuCl2
|
CuBr2
|
|
颜色(无水物)
|
白色
|
黄棕色
|
棕黑色
|
|
熔
点/K
|
1223
|
771
|
分解
|
|
溶解度/(298K,g/100g水)
|
0.075(298K)
|
72.7
|
126.8
|
卤化铜随阴离子变形性增大,颜色加深。CuCl2在很浓的溶液中显黄绿色,在浓溶液中显绿色,在稀溶液中显蓝色。黄色是由于[CuCl4]2-配离子的存在,而蓝色是由于[Cu(H2O)6]2+配离子的存在,两者并存时显绿色。
CuCl2在空气中潮解,它不但易溶于水,而且易溶于乙醇和丙酮。CuCl2与碱金属氯化物反应,生成MⅠ[CuCl3]或MⅠ2[CuCl4]型配盐,与盐酸反应而生成H2[CuCl4]配酸,由于Cu2+卤配离子不够稳定,只能在有过量卤离子时形成。
CuCl2.2H2O受热时,按下式分解:
CuCl2.2H2O
 Cu(OH)2.CuCl2
+ 2HCl↑ Cu(OH)2.CuCl2
+ 2HCl↑
所以制备无水CuCl2时,要在HCl气流中将CuCl2.2H2O加热到413-423K的条件下进行。无水CuCl2进一步受热,则按下式进行分解:
2CuCl2  2CuCl + Cl2↑
2CuCl + Cl2↑
CuBr2溶于HBr中呈特征的紫色(认为是配离子[CuBr3]-的颜色),
1mL溶液中含有0.05mgCuBr2即显紫色,
可用该法检验溶液中的Cu2+离子。

一: 硫化亚铜
硫化亚铜是难溶的(Ksp=2×10-47)黑色物质,它可由过量的铜和硫加热制得:
2Cu + S  Cu2S
Cu2S
在硫酸铜溶液中,加入硫代硫酸钠溶液,加热,也能生成Cu2S沉淀,在分析化学中常用此反应除去铜:
2Cu2+ + 2S2O32- + 2H2O
 Cu2S↓+
S↓+ 2SO42- + 4H+ Cu2S↓+
S↓+ 2SO42- + 4H+
Cu2S不溶于水,也不溶于非氧化性的酸,但可溶于硝酸和KCN溶液。
3Cu2S + 22HNO3  6Cu(NO3)2
+ 3H2SO4 + 10NO + 8H2O
6Cu(NO3)2
+ 3H2SO4 + 10NO + 8H2O
Cu2S + 8KCN  2K3[Cu(CN)4]
+ K2S 2K3[Cu(CN)4]
+ K2S
二:硫化铜
在Cu2+盐溶液中通入H2S就生成黑色的CuS沉淀:
Cu2+ + H2S  CuS↓
+ 2H+
CuS↓
+ 2H+
CuS不溶于水(Ksp=6×10-36),也不溶于稀酸,但溶于热的稀HNO3中:
2CuS + 2NO3- + 8H+  3Cu2+
+ 2NO↑+ 3S↓+ 4H2O
3Cu2+
+ 2NO↑+ 3S↓+ 4H2O
CuS也溶于浓的NaCN溶液中,生成[Cu(CN)4]3-配离子:
2CuS + 10CN-  2[Cu(CN)4]3-
+ 2S2- + (CN)2↑ 2[Cu(CN)4]3-
+ 2S2- + (CN)2↑

一: 硫酸铜
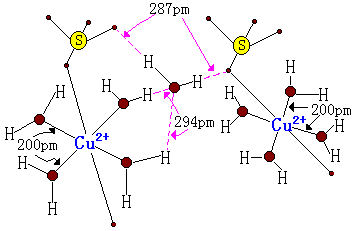
五水硫酸铜CuSO4·5H2O俗名胆矾或蓝矾,是蓝色斜方晶体。下图为CuSO4.5H2O的结构示意图.
在蓝色的CuSO4.5H2O中,四个水分子以平面四边形配位在Cu2+的周围,第五个水分子以氢键与硫酸根结合,SO42-离子在平面四边形的上和下,形成一个不规则的八面体。
五水硫酸铜在不同的温度下,可以发生下列反应:
无水硫酸铜为白色粉末,不溶于乙醇和乙醚,其吸水性很强,吸水后即显出特征的蓝色。可利用这一性质来检验乙醇、乙醚的有机溶剂中的微量水分。也可以用无水硫酸铜从这些有机物中除去少量水分(作干燥剂)。
向硫酸铜溶液中加入少量氨水,得到的不是氢氧化铜,而是浅蓝色的碱式硫酸铜沉淀:
2CuSO4 + 2NH3.H2O
 (NH3)2SO4
+ Cu2(OH)2SO4↓ (NH3)2SO4
+ Cu2(OH)2SO4↓
若继续加入氨水,碱性硫酸铜沉淀就溶解,得到深蓝色的四氨合铜配离子:
Cu2(OH)2SO4
+ 8NH3  2[Cu(NH3)4]2+
+ SO42- + 2OH-
2[Cu(NH3)4]2+
+ SO42- + 2OH-
这个铜氨溶液具有溶解纤维的能力,在所得的纤维溶液中再加酸时,纤维又可沉淀析出。工业上利用这种性质来制造人造丝。
硫酸铜是制备其它含铜化合物的重要原料,在工业上用于镀铜和制颜料。在农业上同石灰乳混合得到波尔多液,通常的配方是:
CuSO4.5H2O:CaO:H2O=1:1:100
波尔多液在农业上,尤其在果园中是最常见的杀菌剂。
二: 硝酸铜
硝酸铜的水合物有Cu(NO3)2.3H2O、Cu(NO3)2.6H2O和Cu(NO3)2.9H2O。将Cu(NO3)2.3H2O加热到443K时,得到碱式盐Cu(NO3)2.Cu(OH)2,进一步加热到473K则分解为CuO。多年以来人们一直认为过渡金属没有无水硝酸盐。现在知道水是一种比硝酸根更强的配体,所以水合硝酸盐在加热时失去硝酸根而不是失水。
制备无水Cu(NO3)2是将铜溶于乙酸乙酯的N2O4溶液中,从溶液中结晶出Cu(NO3)2N2O4。将它加热到363K,得到蓝色的Cu(NO3)2。Cu(NO3)2在真空中加热到473K,它升华但不分解。

一:Cu2+的配合物
Cu2+离子的外层电子构型为3s23p63d9。Cu2+离子带两个正电荷,因此,比Cu+更容易形成配合物。Cu2+的配位数为2、4、6的配离子,配位数为2的很稀少。
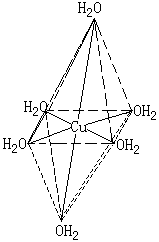
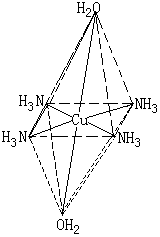
当Cu2+盐溶解在过量的水中时,形成蓝色的水合离子[Cu(H2O)6]2+。在[Cu(H2O)6]2+中加入氨水,容易形成深蓝色的[Cu(NH3)4(H2O)2]2+离子,但第五、六个水分子的取代比较困难。[Cu(NH3)6]2+仅能在液氨中制得。在固体水合盐中一般配位数为4。
一般Cu(Ⅱ)配离子有变形八面体或平面正方形结构,如下图所示,在不规则的八面体中,有四个等长的短键和二个长键,二个长键在八面体相对的两端点。对于[Cu(NH3)4(H2O)2]2+离子,经常用[Cu(NH3)4]2+来表示四个NH3分子是以短键与Cu2+结合,所以这个配离子也可以用平面正方形结构描述。
 |
 |
| [Cu(H2O)6]2+离子 |
[Cu(NH3)4(H2O)2]2+离子 |
Cu2+离子还能与卤素、羟基、焦磷酸根、硫代硫酸根形成稳定程度不同的配离子。Cu2+与卤素离子都能形成[MX4]2-型配合物,但它们在水溶液中的稳定性较差。
二:Cu+的配合物
Cu+也能形成许多配合物,其配位数可以为2、3、4。配位数为2的配离子,用sp杂化轨道成键,几何构型为直线型,如CuCl2-。配位数为4的配离子,用sp3杂化轨道成键,几何构型为四面体,如[Cu(CN)4]3-。
Cu2+与CN-形成的配合物在常温下是不稳定的。室温时,在铜盐溶液中加入CN-离子,得到氰化铜的棕黄色沉淀。此物分解生成白色CuCN并放出(CN)2,反应为:
2Cu2+ + 4CN-  (CN)2↑+
2CuCN↓
(CN)2↑+
2CuCN↓
继续加入过量的CN-,CuCN溶解形成无色的[Cu(CN)4]3-:
CuCN + 3CN-  [Cu(CN)4]3-
[Cu(CN)4]3-
[Cu(CN)4]3-极稳定,通入H2S也无Cu2S沉淀生成。利用这种性质,可以将Cu2+与Cd2+进行分离。
铜(Ⅰ)氰配离子用作镀铜的电镀液。因氰化物有毒,所以无氰电镀工艺在迅速发展;如以焦磷酸铜配离子[Cu(P2O7)2]6-作电镀液来取代氰化法镀铜。

铜有氧化态为+Ⅰ和+Ⅱ的化合物。从离子结构来说,Cu+的结构是3d10,应该比Cu2+(3d9)稳定。铜的第二电离势(1970kJ·mol-1)较高,故在气态时Cu+的化合物是稳定的。从反应2Cu+(g)=Cu2+(g)+Cu(s)的△Hθ=866.5kJ·mol-1来看亦是Cu+(g)的化合物比较稳定。但在水溶液中,Cu2+(电荷高、半径小)的水合热(2121kJ·mol-1)比Cu+的(582kJ·mol-1)大得多,据此可以说明Cu+在溶液中是不稳定的,它会歧化为Cu2+和Cu:
2Cu+  Cu + Cu2+
Cu + Cu2+
从下列铜的电势图也可以说明:
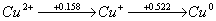
由电势图可见,ψθ右>ψθ左,Cu+变成Cu和Cu2+的歧化趋势大,在293K时,此歧化反应的平衡常数K=[Cu2+]/[Cu+]=1.4×106。由于K很大,溶液中只要有微量的Cu+存在,就几乎全部转化为Cu2+和Cu。所以在水溶液中,Cu2+化合物是稳定的。
Cu+只有当形成沉淀或配合物时,使溶液中Cu+浓度降低到非常小,反歧化的电动势升高到ψθ>0,反应才能向反方向进行,例如,铜与氯化铜在热浓盐酸中形成一价铜的配合物:
Cu
+ CuCl2  2CuCl
2CuCl
CuCl
+ HCl  HCuCl2 HCuCl2
由于生成了配离子[CuCl2]-,溶液中Cu+浓度降低到非常小,反应可继续向右进行到完全程度。前面讲到的Cu2+离子与I-反应由于生成CuI沉淀,也使反应能向生成CuI的方向进行。可见在水溶液中,Cu+的化合物除不溶解的或以配离子的形式存在外,都是不稳定的。
由于Cu2+的极化作用比Cu+强,在高温下,Cu2+化合物变得不稳定,受热变成稳定的Cu+化合物。例如,氧化铜加热到1273K以上,就分解为O2和Cu2O:
4CuO  2Cu2O + O2
2Cu2O + O2
其它如CuS、CuCl2、CuBr2加热至高温都有分解为相应的Cu+化合物的现象。甚至有些化合物如CuI2、Cu(CN)2在普通常温下,就不能存在,要分解为Cu+化合物。可见两种氧化态的铜的化合物各以一定条件而存在,当条件变化时,又相互转化。

|