|
钾的外观以及物理性质和化学性质均与钠相似,但比钠更活泼。
1. 与空气的反应
钾在空气中很快失去银白色金属光泽,表面生成氧化物、氮化物和碳酸盐的外壳。钾在空气中燃烧,生成橙黄色的超氧化钾:
2K + O2 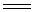 K2O2
K2O2
K + O2  KO2
KO2
2.
与非金属的反应
钾能与电负性较高的非金属如卤素,硫,磷,氮,氢作用,形成相应的化合物。这些化合物一般为离子型化合物。
K + 1/2X2 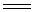 KX
(X=F、Cl、Br、I) KX
(X=F、Cl、Br、I)
2K + H2 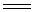 2KH
2KH
2K + S 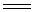 K2S
K2S
3K + P 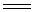 K3P
K3P
3.
与水的反应
金属钾与水剧烈反应,其剧烈程度大于钠,并放出大量热,发生燃烧,生成强碱。
K + H2O
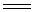 KOH
+ 1/2H2 KOH
+ 1/2H2

一:氧化钾
氧化钾为淡黄色固体,易溶于水,生成KOH。
二:
过氧化钾
过氧化钾的性质与Na2O2相似,可参见钠的性质部分。
三:
超氧化钾
超氧化钾KO2是橙黄色固体,因超氧离子中有一个成单电子,所以具有顺磁性。
KO2是强氧化剂,与H2O剧烈反应生成H2O2和放出O2:
2KO2 + 2H2O
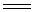 2KOH
+ H2O2 + O2 2KOH
+ H2O2 + O2
MO2还能与CO2反应放出O2:
4KO2 + 2CO2
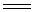 2K2CO3
+ 3O2 2K2CO3
+ 3O2
所以KO2是很好的供养剂。
四:臭氧化钾
臭氧化钾不稳定,室温下缓慢分解,为强氧化剂。
2KO3 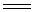 2KO2
+ O2
2KO2
+ O2

KOH为强碱,性质与NaOH相似,只是其碱性比NaOH更强。有关KOH的反应参见NaOH部分。

一:KCl
KCl为白色晶体,熔点1049K,易溶于水,293K时溶解度(克/100克水)为34.7。随温度的升高,KCl的溶解度显著增大。其化学性质与NaCl相似。
二:KNO3
KNO3是无色透明的针状晶体,利用NaNO3与KCl进行复分解反应可得KNO3。
NaNO3 + KCl 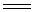 KNO3
+ NaCl
KNO3
+ NaCl
KNO3受热可分解:
2KNO3  2KNO2
+ O2
2KNO2
+ O2
高温下具有强氧化性,它是火药和焰火工业的重要原料。黑火药的主要成分是KNO3(质量百分比75%)、硫磺(10%)和木炭(15%)。爆炸时主要发生如下反应:
2KNO3 + 3C + S 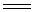 N2
+ 3CO2 + K2S
N2
+ 3CO2 + K2S
4KNO3 + 6C + 2S 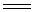 K2S2
+ K2CO3 + CO + 4CO2 + 2N2
K2S2
+ K2CO3 + CO + 4CO2 + 2N2
16KNO3 + 16C + 5S 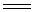 4K2CO3 +
3K2SO4 + K2S2 + 12CO2 +
8N2
4K2CO3 +
3K2SO4 + K2S2 + 12CO2 +
8N2 
|