|
一:物理性质
钠为活泼金属,其银白色金属光泽在空气中很快失去,表面形成由氧化物、氮化物和碳酸盐组成的外壳,所以钠应保存在煤油中。
金属钠硬度低,密度比水轻。钠可溶于汞中形成钠汞齐,它在有机化学中常用作还原剂。
二:化学性质
钠具有很强的还原性,而铷、铯在室温下遇空气就立即燃烧。
1. 与空气的反应:
钠暴露在空气中,其表面很快被氧化。如果在空气中稍加热即燃烧起来。
4Na + O2  2NaO
2NaO
2Na + O2  Na2O2
Na2O2
2.
与非金属的反应
钠能直接或间接与电负性较高的非金属如卤素,硫,磷,氮,氢作用,形成相应的化合物。这些化合物一般为离子型化合物。
Na + 1/2X2  NaX
(X=F、Cl、Br、I) NaX
(X=F、Cl、Br、I)
2Na + H2  2NaH
2NaH
2Na + S  Na2S
Na2S
3Na + P  Na3P
Na3P
3.
与水的反应
钠与水能剧烈反应,放出大量热,并生成NaOH:
Na + H2O
 NaOH
+ 1/2H2 NaOH
+ 1/2H2
4. 高温下的反应
在干态下,高温时钠能夺取氧化物中的氧或氯化物中的氯:
TiCl4 +
4Na  Ti + 4NaCl Ti + 4NaCl
KCl + Na  NaCl + K
NaCl + K
钠是很好的还原剂,在真空或稀有气体保护下用来生产某些稀有金属。

一:氧化钠
氧化钠为白色固体,易溶于水,生成NaOH。在高温下与氧反应可得Na2O2:
2Na2O + O2 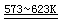 2Na2O2 2Na2O2
二:
过氧化钠
Na2O2为淡黄色粉末,易吸潮。热至773K时很稳定,熔融时几乎不分解。它与水或稀酸在室温下反应生成H2O2,与CO2反应放出O2:
Na2O2 +
2H2O  2NaOH
+ H2O2 2NaOH
+ H2O2
Na2O2
+ H2SO4(稀)  Na2SO4
+ H2O2
Na2SO4
+ H2O2
2Na2O2
+ 2CO2  2Na2CO3
+ O2 2Na2CO3
+ O2
Na2O2是强氧化剂,在熔融态下可把Fe2O3,Cr2O3,MnO2等不溶于酸的矿石氧化为FeO42-,CrO42-,MnO42-.
Fe2O3(s)
+ 3Na2O2(s)  2Na2FeO4(l)
+ Na2O(l)
2Na2FeO4(l)
+ Na2O(l)
MnO2(s) +
Na2O2(s)  2Na2MnO4(l)
2Na2MnO4(l)

一:
物理性质 氢氧化钠为强碱,易溶于H2O,并放出大量热。在空气中易吸湿潮解,所以固体NaOH是很好的干燥剂。NaOH还容易与空气中的CO2反应生成碳盐酸。
NaOH具有强腐蚀性,能腐蚀衣服,皮肤,玻璃,陶瓷等,因此把它叫苛性碱或烧碱. 二:
化学性质
1. 与非金属单质的作用
X2 + 2NaOH  NaX
+ NaXO + H2O (X=Cl,Br,I)
NaX
+ NaXO + H2O (X=Cl,Br,I)
2B + 2NaOH + 6H2O  2Na[B(OH)4]
+ 3H2
2Na[B(OH)4]
+ 3H2
Si + 2NaOH + H2O  Na2SiO3
+ 2H2
Na2SiO3
+ 2H2
4P(固,白色) + 3NaOH + 3H2O
 3NaH2PO4 + PH3↑ 3NaH2PO4 + PH3↑
2. 与两性金属如Al,Zn,Sn…作用
2Al + 2NaOH + 6H2O
 2Na[Al(OH)4]
+ 3H2 2Na[Al(OH)4]
+ 3H2
Zn + 2NaOH + 2H2O
 Na2[Zn(OH)4]
+ H2 Na2[Zn(OH)4]
+ H2
3. 与氧化物作用
室温下,NaOH和SiO2发生如下反应:
2NaOH + SiO2  Na2SiO3
+ H2O
Na2SiO3
+ H2O
因此盛放NaOH溶液的瓶子一定要用橡皮塞而不能用玻璃塞.
NaOH是处理工业废气H2S的良好吸收剂。NaOH也可作CO2气体的吸收剂,在环境监测中可用来测定气体中的CO2含量。
NaOH + H2S  Na2S +
H2O
Na2S +
H2O
2NaOH + CO2  Na2CO3 +
H2O
Na2CO3 +
H2O
长期贮存的NaOH或密封不好时,会因吸收空气中的CO2致使NaOH中混有Na2CO3成分。化学分析中要配制不含碳酸盐的NaOH溶液,可先配制NaOH的饱和溶液,静置后Na2CO3即可沉淀析出,取上层清液即为NaOH的饱和溶液。
由于NaOH熔点较低,熔融态的NaOH具有熔解金属氧化物或非金属氧化物的能力。如:
Al2O3 +
2NaOH  2NaAlO2 +
H2O 2NaAlO2 +
H2O
因此工业生产和分析工作中常用类似反应分解矿石原料和硅酸盐类试样。 
一:钠盐和钾盐的差异
钠盐和钾盐性质很相似,但也有差别,重要的有三点:
1.溶解度
钠、钾盐的溶解度都比较大,相对说来,钠盐更大些。但NaHCO3溶解度不大,NaCl的溶解度随温度的变化不大,这是常见的钠盐中溶解性较特殊的。
2.吸湿性
钠盐的吸湿性比相应的钾盐强。因此,化学分析工作中常用的标准试剂许多是钾盐,如用邻苯二甲酸氢钾标定碱液的浓度,用重铬酸钾标定还原剂溶液的浓度。在配制炸药时用KNO3或KClO3,而不用相应的钠盐。
3.结晶水
含结晶水的钠盐比钾盐多,如Na2SO4·10H2O、Na2HPO4·12H2O等钠的化合物与相应钾的化合物性质上一般很相似,钠的化合物价格要便宜一些,故一般多使用钠的化合物,而不用钾的化合物。但要注意某些特殊情况,如钾肥不能用钠的化合物代替,制硬质玻璃必须用K2CO3,制黑火药一定要用KNO3等。
二:NaCl
NaCl为白色晶体,为离子晶体,其熔点1074K,易溶于水,293K时溶解度(克/100克水)为36.0。温度对NaCl的溶解度影响较小,从273K~373K它在水中的溶解度增加很少。
自然界中NaCl的贮量很大,主要存在于海水和岩盐中。自海水提取食盐采用蒸发结晶的方法,一般是利用太阳能,把海水的水分蒸发,直到NaCl结晶析出。NaCl是重要的化工基本原料,可用于制备多种化工产品如NaOH、Cl2、HCl等。
三:Na2CO3, NaHCO3
碳酸钠和碳酸氢钠均易溶于水,且发生水解反应使溶液呈碱性。
CO32- +
H2O  HCO3- +
OH- HCO3- +
OH-
Na2CO3俗称苏打,工业上亦称纯碱。向Na2CO3溶液中通入CO2,则会转变为NaHCO3。
Na2CO3 +
CO2 + H2O  2NaHCO3 2NaHCO3
NaHCO3俗称小苏打,它的水溶液呈弱碱性。NaHCO3与酒石酸氢钾(KHC4H4O6)混合可作发酵粉。其发酵的主要原理是:
NaHCO3 + KHC4H4O6
 KNaC4H4O6
+ H2O + CO2 KNaC4H4O6
+ H2O + CO2
NaHCO3也是制作泡沫灭火器的主要原料。泡沫灭火器的原理是:
3NaHCO3 + Al2(SO4)3
+ 3H2O  3NaHSO4 +
2Al(OH)3 + 3CO2 3NaHSO4 +
2Al(OH)3 + 3CO2
医药上可用来中和过多的胃酸。
四:Na2SO4:
无水Na2SO4又称元明粉。大量用于玻璃、造纸、水玻璃、陶瓷工业。也是制造Na2S和Na2S2O3·5H2O的原料。
Na2SO4(s)
+ 2C 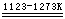 Na2S + 2CO2 Na2S + 2CO2
Na2SO4·10H2O称为芒硝,在空气中会失水而风化。医药上用作泻盐。 
|