|
一:碱金属元素的基本性质
ⅠA的碱金属元素包括锂、钠、钾、铷、铯和钫六种元素,它们的基本性质见下表:
|
元
素
性
质 |
锂 |
钠 |
钾 |
铷 |
铯 |
|
符
号 |
Li |
Na |
K |
Rb |
Cs |
|
原
子 序 数 |
3 |
11 |
19 |
37 |
55 |
| 原
子 量 |
6.941 |
22.99 |
39.098 |
85.47 |
132.91 |
|
价电子构型 |
2s1 |
3s1 |
4s1 |
5s1 |
6s1 |
|
主要氧化态 |
+Ⅰ |
+Ⅰ |
+Ⅰ |
+Ⅰ |
+Ⅰ |
|
原子金属半径(Pm) |
152 |
153.7 |
227.2 |
247.5 |
265.4 |
|
离子半径 |
68 |
97 |
133 |
147 |
167 |
|
第一电离势(kJ/mol) |
521 |
499 |
421 |
405 |
371 |
|
第二电离势(kJ/mol) |
7295 |
4591 |
3088 |
2675 |
2436 |
|
电负性 |
0.98 |
0.93 |
0.82 |
0.82 |
0.79 |
|
标准电极电势(V)
M+(aq)+e-=M(s) |
-3.045 |
-2.711 |
-2.923 |
-2.925 |
-2.923 |
|
M+(g)水合热(kJ/mol) |
519 |
406 |
322 |
293 |
264 |
二:碱金属元素的通性
由于碱金属元素的原子最外层只有一个电子,次外层为8个电子,这种构型对核电荷的屏蔽作用较强,因而造成最外层的一个电子极易失去,所以碱金属的第一电离势是同周期元素中最低的,其金属活泼性最强。原子半径及离子半径也是同周期中最大的。由于最外层只有一个成键电子,在固体中原子间的引力较小,所以它们的熔点,沸点、硬度、升华热都很低。本族元素的电负性都很小,在与别的元素化合时多以形成离子键为特征。
碱金属元素随着从上到下原子序数的增加,其原子半径和离子半径依次增加,电离势和电负性依次降低,金属活泼性依次增强。

一:物理性质
碱金属单质的物理性质见下表:
|
金
属
性 质 |
Li |
Na |
K |
Rb |
Cs |
|
密
度(g/cm3) |
0.534 |
0.971 |
0.86 |
1.532 |
1.873 |
|
沸
点(K) |
1620 |
1156 |
1047 |
961 |
951.5 |
|
熔
点(K) |
453.69 |
370.96 |
336.8 |
312.04 |
301.55 |
|
硬度(金刚石=10) |
0.6 |
0.4 |
0.5 |
0.3 |
0.2 |
|
导电性(Hg=1) |
11.2 |
20.8 |
13.6 |
7.7 |
4.8 |
碱金属单质的洁净表面具有银白色金属光泽。在常温下所有碱金属都属体心立方晶格,配位数为8。碱金属单质具有密度小,硬度小,熔点和沸点低,升华热低,导电性强等特点,是典型的轻金属。如锂、钠、钾均比水轻。
碱金属不但轻而且软,可以用刀任意切割。
碱金属可以相互溶解形成液体合金,如钾钠合金(77.2%K和22.8%Na,熔点为260.7K)。
碱金属及其离子都有特征的火焰颜色。如钠使火焰呈黄色,锂呈红色,钾呈紫色,钾和铯呈蓝紫色。
二:化学性质
碱金属均为活泼金属,都是强还原剂。同族中,从上到下金属活泼性逐渐增强,即还原性也逐渐增强。它们的主要化学性质表现在以下几个方面:
1. 与空气的反应
碱金属在室温下能迅速地与空气中的氧反应,在表面生成一层氧化物,锂的表面还有氮化物。钠、钾在空气中稍加热就燃烧起来,而铷和铯在室温下遇空气就立即燃烧。
2.
与非金属的反应
碱金属能直接或间接与电负性较高的非金属如卤素,硫,磷,氮,氢作用,形成相应的化合物。除Li的化合物外,一般以离子化合物存在。
3.
与水的反应
碱金属与水剧烈反应,放出大量热,并生成强碱.
M + H2O  MOH
+ 1/2H2 M=Li,Na,K,Rb,Cs
MOH
+ 1/2H2 M=Li,Na,K,Rb,Cs
碱金属与水反应的剧烈程度从锂到铯依次增强。
4. 高温下的反应
在干态下,高温时碱金属能夺取氧化物中的氧或氯化物中的氯。

一:普通氧化物
|
氧化物 |
Li2O |
Na2O |
K2O |
Rb2O |
Cs2O |
|
颜
色 |
白色 |
白色 |
淡黄色 |
亮黄色 |
橙黄色 |
|
热稳定性 |
从左到右逐渐降低 |
|
熔
点 |
从左到右逐渐降低 |
|
与水作用 |
剧烈程度从左到右依次增强 |
碱金属氧化物M2O与水化合生成氢氧化物MOH:
M2O + H2O  2MOH 2MOH 二:
过氧化物
除锂外,其他的碱金属均可形成过氧化物M2O2。
过氧化物中含有过氧离子O22-或[-O-O-]2-.其分子轨道排布式为:
[KK(σ2s)2(σ*2s)2(σ2p)2(π2s)4(π*2p)4]
其键级为1,即形成一个σ键。
过氧化物M2O2与水或稀酸在室温下反应生成H2O2,H2O2分解放出O2。利用这一性质可作氧化剂、漂白剂和氧气发生剂。
Na2O2 +
2H2O  2NaOH
+ H2O2 2NaOH
+ H2O2
H2O2  H2O + 1/2O2
H2O + 1/2O2
三:
超氧化物
K,Rb,Cs在过量氧气中燃烧生成超氧化物。超氧离子的结构是:
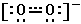
其分子轨道排布式为:
[KK(σ2s)2(σ*2s)2(σ2p)2(π2s)4(π*2p)3]
其键级为1.5,即成键的(σ2p)2构成一个σ键,成键的(π2s)2和反键的(π*2p)1构成一个三电子π键.因O2-的键级小于O2,所以稳定性比O2差。
超氧化物MO2是强氧化剂,与H2O剧烈反应:
2MO2 + 2H2O
 2MOH
+ H2O2 + O2 M=K,Rb,Cs 2MOH
+ H2O2 + O2 M=K,Rb,Cs
MO2与CO2反应放出O2:
4MO2 + 2CO2
 2M2CO3
+ 3O2 M=K,Rb,Cs 2M2CO3
+ 3O2 M=K,Rb,Cs
所以MO2是很好的供养剂。 四:臭氧化物
K,Rb,Cs均可生成臭氧化物MO3。臭氧离子的结构是:
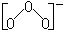
臭氧化物不稳定,室温下缓慢分解,为强氧化剂。如:
2KO3
 2KO2
+ O2 2KO2
+ O2

碱金属氢氧化物的一些物理性质列于下表中.
|
性
质 |
LiOH |
NaOH |
KOH |
RbOH |
CsOH |
|
颜
色 |
白 |
白 |
白 |
白 |
白 |
|
状态(室温) |
固 |
固 |
固 |
固 |
固 |
|
熔点(K) |
723 |
591 |
633 |
574 |
545 |
|
水中溶解度(mol/L) |
5.3 |
26.4 |
19.1 |
17.9 |
25.8 |
|
溶解热(kJ/mol) |
23.4 |
44.4 |
57.1 |
62.3 |
74.5 |
|
碱
性 |
从左到右碱性依次增强 |
碱金属氢氧化物的碱性变化规律可用离子势φ(=Z/r)大小来解释。当Z值(所带电荷数)相同时,从上到下半径r增大,则φ值减小。φ值越小,则碱性越强。所以从LiOH到CsOH碱性依次增强。
碱金属氢氧化物的突出化学性质是强碱性。它们的水溶液和熔融物,既能溶解某些两性金属(如Al、Zn等)及其氧化物,也能溶解许多非金属及其氧化物。

碱金属常见的盐有卤化物、硝酸盐、硫酸盐、碳酸盐和磷酸盐等。碱金属盐类的共同性质可归纳为下述几点。
一:晶型、颜色
碱金属盐绝大多数是离子型晶体,晶体多数属NaCl型,铯的卤化物是CsCl型结构,它们的熔点均较高。只有Li+
离子由于半径最小,极化力较强,它的某些盐如卤化物表现出不同程度的共价性。它们的化合物的颜色决定于阴离子,若阴离子无色,例如:O2-、OH-、NO3-、ClO3-、SO42-,CO32-等,则其化合物为无色或白色。若阴离子有色,则化合物显阴离子的颜色,例如CrO42-为黄色,则Na2CrO4亦为黄色。
二:溶解性及在水溶液中的性质
碱金属的盐类大多数易溶于水,如卤化物、碳酸盐、硝酸盐、硫酸盐、磷酸盐,且在水中完全电离。它们的碳酸盐、硫酸盐的溶解度从Li-Cs依次增大。
只有少数盐类难溶。如Li2CO3、Li3PO4、LiF。
难溶的钠盐有:
Na[Sb(OH)6]
六羟基锑酸钠
白色晶体
NaAc·Zn(Ac)2·3UO2(Ac)2·9H2O
醋酸钠酰锌钠 淡黄色晶体
难溶的钾盐有:
KClO4
高氯酸钾 白色
KB(C6H5)4
四苯硼酸钾 白色
KHC4H4O6
酒石酸氢钾 白色
K2[PtCl6] 六氯铂酸钾
淡黄色
K2Na[Co(NO2)6] 钴亚硝酸钠钾
亮黄色
除上述盐以外,几乎所有碱金属盐类不论在晶体中还是在水溶液中均无色。
三:焰色反应
碱金属和钙、锶、钡的挥发性盐在无色火焰中灼烧时,能使火焰呈现出一定颜色,这叫“焰色反应”。原子的结构不同,灼烧时就发出不同波长的光,所以光的颜色也不同。利用焰色反应,可以根据火焰的颜色定性的鉴别这些元素的存在与否。
|
离
子 |
Li+ |
Na+ |
K+ |
Rb+ |
Cs+ |
Ca2+ |
Sr2+ |
Ba2+ |
|
焰
色 |
红 |
黄 |
紫 |
紫红 |
紫红 |
橙红 |
红 |
黄绿 |
|
波长/nm |
670.8
|
589.0
589.6 |
404.4
404.7 |
420.2
629.8 |
455.5
459.8 |
612.2
616.2 |
687.8
707.0 |
553.6
|
四:形成结晶水合物的倾向
一般来说,离子愈小,它所带的电荷愈多,则作用于水分子的电场愈强,它的水合热愈大,结合的水分子越多。碱金属离子是最大的正离子,离子电荷最少,故它的水合热常小于其它离子。
碱金属离子的水合能力从Li+到Cs+是降低的,这也反映在盐类形成结晶水合物的倾向上。几乎所有的锂盐都是水合的,钠盐约有75%是水合的,钾盐有25%是水合物,铷盐和铯盐仅有少数是水合盐。在常见的碱金属盐中,卤化物大多数是无水的,硝酸盐中只有锂可形成水合物,如LiNO3·H2O和LiNO3·3H2O,硫酸盐中只有Li2SO4·H2O和Na2SO4·10H2O,碳酸盐中除Li2CO3无水合物外,其余皆有不同形式的水合物,其水分子数分别为:
Na2CO3
K2CO3 Rb2CO3
Cs2CO3
1,7,10 1,5
1,5 3,5
五:形成复盐的能力
除锂以外,碱金属还能形成一系列复盐。复盐有以下几种类型:
光卤石类,通式为MⅠCl·MgCl2·6H2O,其中MⅠ=K+、Rb+、Cs+,如光卤石 KCl·MgCl2·6H2O;
通式为M2ⅠSO4·MgSO4·6H2O的矾类,其中MⅠ=K+、Rb+、Cs+,如软钾镁矾K2SO4·MgSO4·6H2O;
通式为MⅠMⅢ(SO4)2·12H2O的矾类,其中MⅠ=Na+、K+、Rb+、Cs+,MⅢ=Al3+,Cr3+,Fe3+、Co3+、Ga3+、V3+等离子,如明矾KAl(SO4)2·12H2O。
复盐的溶解度一般比相应简单碱金属盐小得多。
六:热稳定性
一般碱金属盐具有较高的热稳定性。卤化物在高温时挥发而难分解。硫酸盐在高温下既难挥发,又难分解。碳酸盐除Li2CO3在1543K以上分解为Li2O和CO2外,其余更难分解。唯有硝酸盐热稳定性较低,加热到一定温度就可分解,例如:
4LiNO3  2Li2O +
4NO2 + O2
2Li2O +
4NO2 + O2
NaNO3 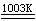 2NaNO2 +
O2
2NaNO2 +
O2
2KNO3 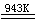 2KNO2 +
O2
2KNO2 +
O2
盐的热稳定性的规律可用离子极化的观点加以说明. 
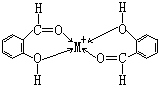
金属离子中,钠、钾、铷、铯离子因电荷少,半径大和没有晶体场稳定化效应,形成一般配合物的倾向最小。它们能与配位能力较强的螯合剂作用,生成螯合物。所有碱金属都可以和水杨醛作用,生成配位数为4的配位化合物。

|
