|
一:物理性质
单质氢是以双原子分子形式存在,它是一个无色无嗅的气体,沸点20.28K,在标况下氢气的密度0.08987kg·L-1,是所有气体中密度最低的。氢具有很大的扩散速度和很高的导热性。如将氢气进行深度冷冻并加压,可转变成液体,在13.84K时氢可转变为透明固体。
氢在水中微溶解,273K时1体积水仅能溶解0.02体积的氢气。但氢可被某些金属(如钯、铂)吸附,如室温时,一体积细钯粉大约吸收900体积的氢气。被吸附后的氢气有很强的化学活泼性(可以认为被吸附的氢分子在某种程度上被离子化或活化了)。
二:化学性质
因氢分子中H-H键能较高(432kJ/mol),所以常温下,氢气表现出较大的化学稳定性,但加热时氢能参加许多化学反应。
1.氢的可燃性
点燃氢气与氧气的混合物,可以爆炸化合生成水,同时释放出大量的热。
H2(g) + 1/2O2(g)  H2O(l)
△Hθ=-286.5kJ/mol
H2O(l)
△Hθ=-286.5kJ/mol
氢在氧气中燃烧可释放出大量的热,使用氢氧吹管有可能达到3000K的高温,这种吹管所产生的氢氧焰可以用来"切割”金属板。
2.氢的还原性
氢可以和许多金属氧化物、卤化物等在加热的情况下相互发生反应,显示氢的还原性,如:
CuO + H2
 Cu +
H2O Cu +
H2O
Fe3O4 +
4H2  3Fe +
4H2O 3Fe +
4H2O
WO3 +
3H2  W +
3H2O W +
3H2O
TiCl4 +
2H2  Ti + 4HCl Ti + 4HCl
3.氢的氧化性
氢可以和ⅠA族ⅡA族(除Be,Mg)活泼金属相互反应,生成离子型氢化物。在离子型氢化物中,氢接受电子生成负一价氢离子,显示氢的氧化性。
2Na + H2 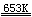 2NaH
2NaH
Ca + H2 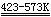 CaH2
CaH2
氢也可以与一些电负性较大的非金属相互化合.形成各种不同的分子型氢化物。如有机化学中的加氢或脱氢反应。
|
CH3CHO +
H2 |

|
CH3CH2OH |
4.加合反应
在适当温度及催化剂的条件下,氢可以和一氧化碳合成一系列有机化合物(如生成甲醇、烃类等)。氢也可以使不饱和碳氢化合物加氢,转变成饱和碳氢化合物。如
2H2 +
CO  CH3OH CH3OH
CH≡CH + H2
 CH2=CH2 CH2=CH2
5.氢与某些金属生成金属型氢化物
氢气可以与某些金属反应生成一类外观似金属的金属型氢化物,这类氢化物中,氢与金属的比值有的是整数比,有的是非整数比的,其性质在后面介绍。

当氢同电负性很小的ⅠA及ⅡA族(除Be,Mg外)金属直接化合时,氢就倾向于从这些金属获取一个电子形成负一价氢离子(H-)。但由于氢成为负一价离子的趋势远小于卤素的这种趋势,所以在较高温度下才能生成离子型氢化物.
这类氢化物晶体结构的特点是金属正离子与氢负离子分别占据着晶格结点,因此这种类型的氢化物又称为类盐型或离子型氢化物。它们都是白色晶体,但常因含少量金属而呈灰色。
除LiH、BaH2具有较高的稳定性以外,其余的氢化物都在熔融温度以前分解为单质。类盐型氢化物遇水分解,生成金属氢氧化物并放出氢气。此性质常用来制取少量氢气。
氢负离子(H-)具有较大的离子半径(208Pm),这是由于氢仅有的一个质子吸引两个互相排斥的自旋相反的电子的结果,因此氢负离子不稳定,有强烈的失电子的趋势。这类氢化物都具有强还原性,均属强还原剂。在高温下可以还原金属氯化物、氧化物及含氧酸盐。如
TiCl4 + 4NaH  4NaCl + Ti +
2H2
4NaCl + Ti +
2H2
UO2 + CaH2
 U +
Ca(OH)2 U +
Ca(OH)2
离子型氢化物在非极性溶剂中,与B2H6,AlCl3等可形成复合氢化物,例如
2LiH + B2H6
 2LiBH4 2LiBH4
4LiH + AlCl3
 LiAlH4
+ 3LiCl
LiAlH4
+ 3LiCl

氢与p区元素(除稀有气体及ⅢA族的In,Tl外)生成分子型氢化物,因为p区元素与氢电负性相差不大,所以氢是通过共用电子对的方式来成健的。这种方式形成的氢化物属分子型氢化物。分子型氢化物从晶格类型划分是属于分子晶体,晶格结点间的作用力是分子间力,因此分子型氢化物具有低熔沸点。一般情况下,分子型氢化物多为气体。
由于p区元素电负性不同,当形成分子型氢化物时,共用电子对的偏移不同,因此在分子型氢化物中,氢的形式电荷数可以是+I或-I。这类氢化物性质相差较多,如在与水的反应上SiH4被水分解。
SiH4 + 4H2O
 H4SiO4 +
4H2 H4SiO4 +
4H2
NH3与水发生加合反应,使溶液显弱碱性
NH3 + H2O
 NH3·H20 NH3·H20  NH4+ +
OH-
NH4+ +
OH-
H2S、HX(卤化氢)等在水中除溶解以外,还发生电离产生H+,使它们的水溶液呈显酸性,
HX  H+ +
X-
H+ +
X-
H2S  H+ +
HS-
H+ +
HS-
HS-  H+
+ S2-
H+
+ S2-
但不同氢化物电离难易程度并不一样,因此有些呈显强酸性,有的呈弱酸性。但也有些氢化物(如C,Ge等)与水不发生任何作用。

周期表中间的部位,包括Be、Mg、In、Tl及d区、f区金属元素都可以和氢生成金属型氢化物,这类氢化物中有的是整数比化合物,如BeH2、MgH2、FeH2、NiH2、CuH、UH3,有的是非整数比化合物,如VHO.56、TaHO.36、ZrH1.92。
从物理性质看,金属型氢化物基本上保留了金属外观特征,有金属光泽,密度比相应的金属要小,如CeH2.69密度比金属铈小17.5%。从化学性质上,铍、镁、镧系金属、锕系金属等的氢化物多类似于离子型氢化物,而In、Tl、铜族、锌族金属的氢化物则多类似于共价型氢化物,从而这类氢化物也称为过渡型氢化物。

|