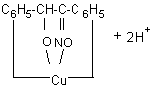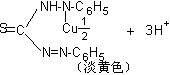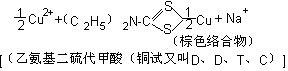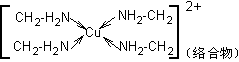|
Cu2I2 |
||
|
Cu2I2 + I2 |
|
2CuI2 |
|
Cu2I2 + 3MnO2 |
|
2CuO + Mn3O4 + I2 |
|
Cu2I2 + 2NH4I |
|
(NH4I)2Cu2I2(冷却时进行的反应) |
|
2CuI2 |
|
Cu2I2 + I2 |
|
2CuS + O2 |
|
Cu2S + SO2↑ |
|
CuS + Zn + 2H+ |
|
Cu↓+ Zn2+ + H2S↑ |
|
CuS + 2Cu2O |
|
5Cu + SO2↑ |
|
3CuS + 14HNO3(浓) |
|
3Cu(NO3)2 + 3H2SO4 + 6NO + 4H2O |
|
CuS + 2HNO3(浓) |
|
Cu(NO3)2 + H2S |
|
H2S + 8HNO3(浓) |
|
8NO2↑+ H2SO4 + 4H2O |
|
总式:CuS + 10HNO3(浓) |
|
Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O |
|
3CuS(s) + 8HNO3(浓,稀) |
|
3Cu(NO3)2 + 3S↓ + 2NO↑ + 4H2O(这里的HNO3,其中只有1/4作为氧化剂,1/4作为酸,作为酸的部分也可改用HCl) |
|
3CuS(s) + 2HNO3(浓) + 6HCl |
|
3CuCl2 + 3S↓+ 2NO↑+ 4H2O |
|
2CuS + 10CN- |
|
2[Cu(CN)4]3- + 2S2- + (CN)2 |
|
2CuS + 10KCN |
|
2K3Cu(CN)4 + 2K2S + (CN)2 |
|
CuS + 2Ag+ |
|
Ag2S + Cu2+ |
|
2Cu2S + 3O2 |
|
2Cu2O + 2SO2↑(炼铜炉的反应) |
|
2Cu2S + 5O2 |
|
2CuSO4 + 2CuO(在空气中加热) |
|
Cu2S + 2Cu2O |
|
6Cu + SO2↑ |
|
Cu2S + 2CuO |
|
4Cu + SO2↑(反射炉内的反应) |
|
3Cu2S + 22HNO3 |
|
6Cu(NO3)2 + 3H2SO4 + 10NO↑+ 8H2O |
|
nCu2S + nFeS |
|
冰铜 |
|
Cu2S + 8KCN |
|
2K3Cu(CN)4 + K2S |
|
Cu2S + 4CN- |
|
2[Cu(CN)2]- + S2- |
|
Cu2S + Fe2(SO4)3 |
|
CuS + CuSO4 + 2FeSO4(使Cu2S溶解的反应) |
|
Cu2S + 4Ag+ |
|
Ag2S + 2Ag + 2Cu2+ |
|
2CuCN + 2FeCl3 |
|
2CuCl + 2FeCl2 + (CN)2 |
|
CuSCN + NaOH(热) |
|
CuOH + NaSCN |
|
10CuSCN + 14KMnO4 + 21H2SO4 |
|
7K2SO4 + 10HCN + 14MnSO4 + 10CuSO4 + 16H2O |
|
4Cu2(SCN)2 |
|
4Cu2S + 2CS2↑+ 3(CN)2↑+ N2↑ |
|
Cu2SO4 |
|
CuSO4 + Cu↓(在水中的分解反应) |
|
2Cu2SO4(干燥) + O2(干燥) |
|
2CuO + 2CuSO4 |
|
Cu2SO4 + NaOH |
|
Cu2O + NaHSO4 |
|
2Cu(NO3)2 |
|
2CuO + 4NO2↑+ O2↑ |
|
2Cu(NO3)2 |
|
2CuO + 4NO + 3O2↑ |
|
Cu(NO3)2 + 4NH3 |
|
[Cu(NO3)4](NO3)2 |
|
Cu2+ + 4NH3·H2O |
|
Cu(NO3)42+ + 4H2O |
|
Cu(NO3)2 + ZnS |
|
CuS↓+ Zn(NO3)2 |
|
Cu(NO3)2 + Pb(NO3)2 + 2NH4NO3 + 6NaNO2 |
|
6NaNO3 + CuPb(NO3)2·6NO2↓(黑色) |
|
3Cu(NO3)2(冷,饱和) + 3Na2CO3(冷) + H2O |
|
2CuCO3·Cu(OH)2↓+ 6NaNO3 + CO2↑ |
|
Cu(NO3)2 + K2CrO4 |
|
CuCrO4↓+ 2KNO3 |
|
Cu(PO3)2 + H2S |
|
2HPO3 + CuS↓ |
|
Cu(PO3)2 + (NH4)2S |
|
2NH4PO3 + CuS↓ |
|
CuSiO3·2H2O + H2SO4 |
|
CuSO4 + SiO2 + 3H2O |
|
CuCO3 |
|
CuO + CO2↑ |
|
CuCO3 + 2HCl |
|
CuCl2 + H2O + CO2↑(HF,HBr均可发生类似的反应) |
|
CuCO3 + Na2CO3 + 3H2O |
|
CuCO3·Na2CO3 + 3H2O(蓝色) |
|
2Cu(CH3COO)2 + 4KI |
|
Cu2I2↓+ 4KC2H3O2 + I2 |
|
4Cu(CH3COO)2 + K2SO4 + 7H2O |
|
2KC2H3O2
+ CuSO4·3CuO·4H2O↓(淡蓝色) + |
|
4Cu(CH3COO)2 + (NH4)2SO4 + 7H2O |
|
6HC2H3O2 + 2NH4C2H3O2 + CuSO4·3CuO·4H2O↓ |
|
3Cu(CH3COO)2 + CuSO4 + 7H2O |
|
CuSO4·3CuO·4H2O↓+ 6HC2H3O2 |
|
Cu2(OH)2CO3(s) |
|
2CuO + CO2↑+ H2O |
|
Cu2(OH)2CO3 |
|
2Cu2+ + 2OH- + CO32- |
|
Cu+ + 2NH3 |
|
[Cu(NH3)2]+ |
|
2Cu+ +
2OH- |
||
|
2Cu+ + S2- |
|
Cu2S↓ |
|
Cu+ + 4CN- |
|
Cu(CN)43- |
|
Cu+ + S2O32- |
|
Cu(S2O3)- |
|
2Cu2+ + 2Cl- + SO2 + 2H2O |
|
Cu2Cl2↓+ SO42- + 4H+ |
|
2Cu2+ + 4I- |
|
Cu2I2↓(白色) + I2 |
|
CuI + CNS- |
|
CuCNS↓+ I- |
|
2Cu2+ + 4CN- |
|
Cu2(CN)2↓(白色) + (CN)2↑ |
|
2Cu2+ + [Fe(CN)6]4- |
|
Cu2[Fe(CN)6]↓(砖红色) |
|
2Cu2+ + K4Fe(CN)6 |
|
Cu2[Fe(CN)6]↓+ 4K+ |
|
Cu2[Fe(CN)6] + 4OH- |
|
2Cu(OH)2 + [Fe(CN)6]4- |
|
Cu2+ + 2CNS- |
|
Cu(CSN)2↓ |
|
2Cu2+ + 2CNS- + H2SO4 + H2O |
|
Cu2(CNS)2↓+ SO42- + 4H+ |
|
Cu2+ + S2- |
|
CuS(中性或微酸性中) |
|
2Cu2+ + 2S2O32- + 2H2O |
|
Cu2S↓+ 4H+ + 2SO42- + S↓(酸性溶液中) |
|
Cu2+ + 2S2O32- |
|
2Cu+ + S4O62- |
|
Cu+ + S2O32- |
|
Cu(S2O3)-(在过量的S2O32-存在下) |
|
3Cu2+ + 2HPO42- |
|
Cu3(PO4)2(淡蓝色) + 2H+ |
|
Cu2+ + 4NH3·H2O |
|
[Cu(NH3)4]2+ + 4H2O |
|
Cu2+ + EDTA(H2Y2-) |
|
CuY2- + 2H+(EDTA系指乙二胺四乙酸盐) |
|
Cu2+ + C6H5CHCNOHC6H5(试铜灵) |
|
|
|
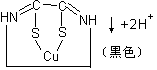
注:Cu2+与硫脲作用先将Cu2+变成Cu+然后Cu+再与硫脲发生反应,得稳定的络合物: |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu2+ + 2[C6H5(CO)NO]-(试铜特灵) |
|
Cu[C6H5(CO)NO]2(易溶于水而生成蓝色溶液) |
|
Cu2+ + (CSNH2)2(二硫代乙二胺) |
|
|
|
|
|
|
|
Cu2FeS3 + 9Ag+ |
|
3Ag2S + 3Ag + 3Cu2+ + Fe3+ |
|
2CuFeS2(黄铜矿) + O2 |
|
Cu2S + 2FeS + SO2↑ |
|
[Cu(NH3)4]2+ + Cu |
|
2[Cu(NH3)2]+ |
|
[Cu(NH3)4]SO4 + 2H2SO4 |
|
2(NH4)2SO4 + CuSO4 |
|
[Cu(NH3)4]2+ + S2- |
|
CuS + 4NH3 |
|
[Cu(NH3)4]2+ + 4H+ + 4H2O |
|
Cu(H2O)42+ + 4NH4+ |
|
2[Cu(NH3)4]2+ + 4CN- |
|
2Cu(CN)2 + 8NH3 |
|
2Cu(CN)2 |
|
(CN)2 + 2CuCN↓(白色) |
|
2[Cu(NH3)2]+ + 4NH3·H2O + O2 |
|
2[Cu(NH3)4]2+ + 4OH- + 2H2O |
|
Cu(NH3)2Cl(氯化亚铜氨) + CO |
|
Cu(NH3)2Cl·CO(一氧化碳氯化铜氨络合物) |
|
[CuCl4]2- + Cu |
|
2[CuCl2]- |
|
因为ε0>0,反应可以进行。ε0表示氧化还原反应中原电池的电动势。如果ε0>0,电极反应可以按指定方向自发地进行,如果ε0<0,电极反应就不能按指定方向自发地进行,而是按相反方向进行。 |
||