
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓缓冲溶液,是指能维持溶液的酸度,使溶液的pH不因外加少量酸、减或溶液的稀释而发生显著变化的一类溶液体系。中学化学中虽然没有涉及“缓冲溶液”这个名词,但春内容时有所及,涉及最多的是弱酸与弱酸强咸盐组成的缓冲溶液这类溶液中的几个难点问题有必要进行澄清,现以Hac—NaAc混合溶液为例加以说明。
在Hac—NaAc混合溶液中,既有醋酸的电离平衡:CH3COOH====CH3COO—+H+
又有醋酸钠的不解平衡:CH3COO—+H2O====CH3COOH+OH—
两大平衡交织,进而产生诸多新的问题将这些问题销加梳理,可旭结为三大问题,即:溶液的酸碱性问题、电离水解相互关系问题和稀释对溶液pH影响问题。
一、 溶液的酸碱性问题——溶液显什么性?
溶液显酸性还是显碱性?要理清这一问题,不妨从纯本醋酸钠入手分析。醋酸钠溶于水时,完全电离成醋酸根离子和纳离子:
CH3COONa====CH3COO+Na+
CH3COO—结合水所电离出来的H+生成CH3COOH而使水的电离平衡右移,OH—增多,从而溶液显碱性。在这一过程中我们销加留意就会发现,水解一经发生就有CH3COOH处于共存状态。有CH3COOH必有电离,因此过程中水解与电离同时存在。只是CH3COOH与CH3COOH与CH3COO—力量对比悬殊,水解占绝对优势而已。
当往上述溶液中外加醋酸时,这种格局就会逐渐打破。随着醋酸的加入,溶液中醋酸分子浓度随之升高,醋酸电离的趋势亦随之增大,电离平衡:CH3COOH====CH3COO—+H+
右移。变化初期,尽管电离趋势上升,但仍不敌水解,溶液中c(OH—>c(H+)关系没有得到根本改变,溶液依然显碱性。当这种趋势发展到某一个“度”时,双方力量对经会发生质的变化,醋酸的电离就要以与醋酸纳的不解相抗衡。若继续外加醋酸,电离趋势就会转变成优势,从而主导溶液的酸碱性。很显然,溶液的酸碱性取决于水解、电离双方力量对比,若水解占上风,则溶液显碱性;若电离占上风,则溶液显酸性;若矛盾方双势均力敌,则溶液显中性。
这种基于过程分析的定性表述我们可以借助电荷守恒原理加以“量化”。不管醋酸与醋酸纳共存溶液处于哪一种状态,溶液中始终存在
例1 将0.2mol/L CH3COOK与0.1mol/L HCl等体积混合后,溶液中有关粒子的物质的量浓度的关系正确的是( )。
解析 二者混合立即发生复分解反应生成CH3COOH,构成CH3COOH、CH3COOK混合溶液且CH3COOH与CH3COOK物质的量相等。在这种情况下,CH3COOH电离占优势,使溶液中CH3COO—、H有所增加,但CH3COOH是弱电解质,发生电离的CH3COOH毕竟少数,大量的是未电离的CH3COOH分子故溶液中有关微粒浓度大小关系为c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)正确选项为D。
二、 电离与水解的相五关系问题——促进还是抑制?
醋酸与醋酸钠共存溶液中电离和水解是相互种进还是相互抑制,有两种完全不同的观点。一种观点认为是相互促进。理由是醋酸钠与醋酸溶入水中后,醋酸钠水解产生氢氧根离子,醋酸则电离产生氢离子,它们各自产生的氢离子与氢氧根离子相互结合成难电离的水,于是既促进了水解平衡,又促进了电离产衡;另一种观点则恰好相反,认为是相互抑制理由是醋酸钠水解不仅产生氢氧根离子,而且产生醋酸分子,当有外加醋酸存在时,溶液中醋酸分子浓度大,从而水解受到抑制。同理,醋酸电离不仅产生氢离子,而且产生醋酸根离子,当有外加醋酸钠存在时,溶液中醋酸根离子浓度较大,电离受到抑制这两种观点似乎都有理,但真正有理的是观点二。第一种观点错在哪里?错在没有处理好直接与间接的关系。醋酸钠水解产生氢氧根离子,醋酸电离产生氢离子,然后两者中和成水,再由此影响醋酸的电离的抑制可说是立竿见影,直接快捷。也就是说,真直接作用大于间接作用醋酸与醋酸钠共存溶液中电离和水解是相互抑制而不是相互促进。虽然这种 抑制关系自始至终存在,但水解、电离这两种趋势也始终存在,当醋酸含量较高时,虽然受到外加醋酸钠的影响,电离度有所减少,但还是表现出相对强劲的电离势头,溶液呈现酸性;同理,当醋酸钠含量较高时,虽然受到外加醋酸的影响,水解度有所减弱,但还是表现出相对强劲的水解势头,使溶液呈现碱性。
例2 CH3COOHa与CH3COOH等物质是量混合所配制成的稀溶液,pH=4.7,则下列说法错误的是( )。
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
解析 混合溶液中醋酸电离平衡与醋酸钠水解平衡共存,现溶液显酸性,说明电离所产生的H+多于水解产生的OH—,故A正确,B不正确。又水解与电离相互抑制,故C、D正确。正确选项为B。
三、 溶液稀释问题——加水时溶液pH怎样改变?
其实,在醋酸、醋酸钠混合溶液中,除了存在醋酸电离平衡。不管醋酸与醋酸钠之间 量的关系如何变化,进而引起溶液中氢离子和氢氧根离子浓度相对量改变,溶液中 c(H+)?C(OH—)=KW这一规律始终不变。C(H+), C(OH—)就好像板子的两端,一个上升,另一个就下降因此,当往溶液中加水时,要判断溶液pH怎么改变,必须先分析对溶液酸碱性决定作用的是氢离子还是氢氧离根离子,再综合考虑对H+, OH—的影响.这是因为起决定作用的离子浓度较大,稀释时其浓度必定变小,再由c(H+)?C(OH—)=KW关系推得另一种离子浓度一定变大具体可分为以下,几种情况
当溶液呈碱性时,醋酸钠量绝对多于醋酸, C(OH—)> c(H+),稀释使C(OH—)变小, c(H+)变大, pH变小;
当溶液呈中性时, C(OH—)> c(H+),离子浓度与水所加水中离子浓度相等,则加水后C(OH—), c(H+)均不变, pH不变;
当溶液呈酸性,且 ![]() <0.1(这种情况下溶液已进入了酸性范围)
<0.1(这种情况下溶液已进入了酸性范围) ![]() >10(溶液中醋酸量比醋酸钠多得多)时,稀释使c(H+)变小C(OH—)变大,pH上升;
>10(溶液中醋酸量比醋酸钠多得多)时,稀释使c(H+)变小C(OH—)变大,pH上升;
值得注意的是,当溶液呈酸性,且0.1< ![]() <10时,稀释对溶液pH 几乎没有影响,这一现象,我们不妨以在醋酸溶液中加入醋酸钠为例,通过应用平衡移动原理来加以解释
<10时,稀释对溶液pH 几乎没有影响,这一现象,我们不妨以在醋酸溶液中加入醋酸钠为例,通过应用平衡移动原理来加以解释
设某醋酸溶液中醋酸起始浓度为C,达电离平衡时电离出的氢离子浓度为xmol/L,当往该溶液中外加醋酸钠晶体,醋酸钠浓度为C1,重新平衡时,溶液中氢离子浓度为xmol/L,则:
HAC====H+ + AC-
未加NaAc时:c-x x x-
加入NaAc时:c-x1 x1 x1+C1
由平衡常数表达式K a= 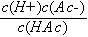 得
得
K a= 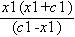 ≈
≈ 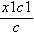
即x1= c(H+)=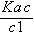
两边取负对数得:pH =pKa-lg 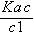
式中,pKa一项是常数pH是否改变取决于醋酸与醋酸钠之间浓度比。稀释时,由于醋酸和醋酸钠浓度同时成比例减小,比值不变,所以不影响溶液和氢离子浓度或pHHAC-NaAc 混合溶液只是弱酸—弱酸强碱盐、弱碱强酸盐等—一系列“缓冲溶液” 的一个实例,则HAC-NaAc混合溶液得出的结论对其它缓冲溶液也是适用的。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是PH?PH是拉丁文“Pondushydrogenii”一词的缩写(Pondus=压强、压力hydrogenium=...
一、水的离子积计算 水的离子积( K w )是一个使用频率较高的化学数据。而一个电极反应...
多元弱酸在水中是分步电离的,因此,计算时应考虑电离 / 反应程度。 向 0.10mol/L 草...
强酸溶液氢离子浓度: HCl 溶液中,完全电离,因此 [H + ]=[ Cl - ] =[H Cl ] 弱酸 溶...
我们接触到的溶剂大部分是水,因而把能够在电离产生水中阳离子(H 3 O + )的物质叫...
碳酸氢钠能和氯化钙反应的道理可以用碳酸氢根离子的“自偶”电离来解释以上现象;碳酸...