
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1869年俄国化学家门捷列夫发现了元素周期律;1913年丹麦科学家玻尔基于氢光谱线状光谱实验,提出氢原子模型、玻尔理论,成功解释了氢原子光谱的线状光谱现象;在此基础上,1920年玻尔提出构造原理,即从氢元素开始,随元素原子序数增加,其核电荷数递增,新增电子填入原子核外“壳层(玻尔壳层,稳定固定的轨道)”的顺序,由此开启用原子结构理论解释元素性质周期性变化——元素周期律(元素性质,原子半径、电离能、电子亲合能、电负性、氧化数等)的新篇章。后来,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子核外电子可能的运动状态,复杂的多电子体系的原子光谱得以获得诠释,现在玻尔的“壳层”一般认为是核外电子出现概率最大的区域,这些理论的发展推动原子结构理论的进步。
构造原理示意图
基于卢瑟福原子结构的核壳结构模型,原子是由带正电的原子核和绕核高速运动的核外电子构成。核外电子按能量不同,分成不同的能层。电子的能层越高,离核越远,电子能量越高,受到原子核的吸引力越小,越容易发生化学反应。同一能层中的电子,按能量高低,又分为不同的能级。
以光谱实验事实为基础,从氢元素开始,随元素核电荷数的增加,新增电子填入能级的顺序成为构造原理图,下图为构造原理示意图:
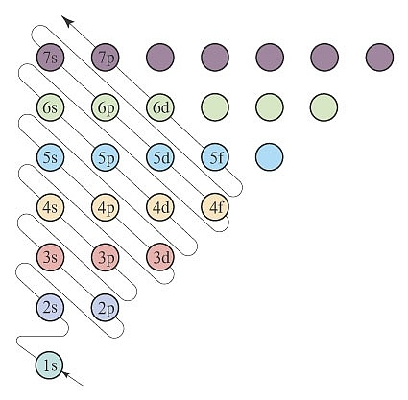
按照构造原理,随元素原子序数增加,相邻元素原子的核电荷数每递增加1个,原子核的核电荷和核外的电子就会同时增加1个,将电子填入构造原理图的相应能级,电子填满一个能级,就开始填入下一个能级,依此就获得到一个基态元素原子的核外电子排布式。
剖析构造原理示意图&元素周期系
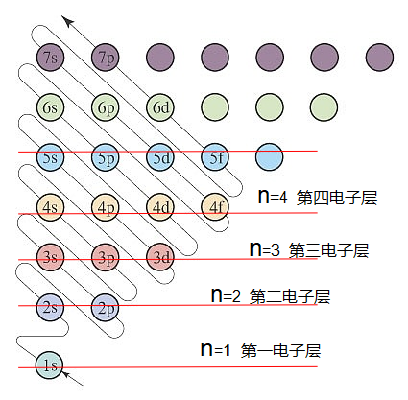
1.从构造原理图,横行分析,获得电子层信息
如下图,每一横行,称为一个电子层,分别是第一电子层、第二电子层、第三电子层…第n电子层;对应主量子数n=1、2、3…n,显然,电子层数分布是按主量子数的变化排列,n值越大,电子层离核越远,层中电子能量越高,愈发不稳定,发生化学反应可能性增加。
2.从构造原理图,蛇形线分析,获得能层、能级、周期等信息
如下图,沿构造原理示意图蛇形线由下而上分析,就可以获得能层、能级信息。
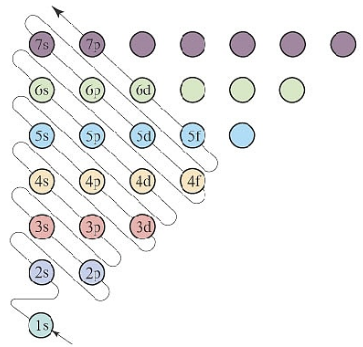
按照能量相近分成一组原则,可以得到能级的分组,称为鲍林原子轨道近似能级图,即:第一能级组、第二能级组、第三能级组…第n能级组,对应不同能层,能层中不同能量的原子轨道称为能级。
(1s)(2s 2p)(3s 3p)(4s 3d 4p)…(ns (n-3)g (n-2)f (n-1)d np)
其中,每个能级组对应元素周期表中的一个周期,因此,能级组的划分是元素周期表划分周期的基础,是核外电子排布的主要依据。如,
第一能级组(1s),对应第一周期,能级中可能的电子排布有:1s1、1s2;对应氢、氦共2种元素。
第二能级组(2s 2p),对应第二周期,能级中可能电子排布有:2s12p0、2s22p0;2s22p1、2s22p2、2s22p3、2s22p4、2s22p5、2s22p6;对应锂到氖,共8种元素。
第三能级组(3s 3p),对应第三周期,能级中可能电子排布有:3s13p0、3s23p0;3s23p1、3s23p2、3s23p3、3s23p4、3s23p5、3s23p6;对应钠到氩,共8种元素。
第四能级组(4s 3d 4p),对应第四周期,能级中可能电子排布:4s电子排布有2种、3d电子排布有10种、4p电子排布有6种,共有18种,对应钾到氪,共18种元素。
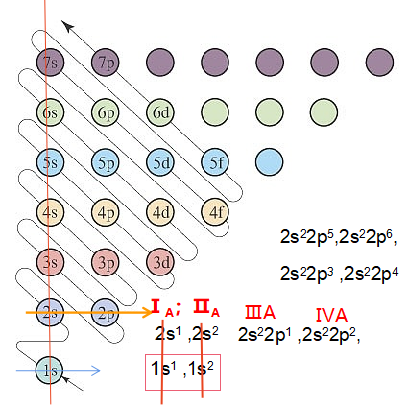
3.从构造原理示意图,纵列分析,获得族、区等信息。
由下图分析,第一纵列,包括:1s、2s、3s、4s、5s、6s…ns等原子轨道。ns原子轨道可以容纳2个电子,即,ns1、ns2;高能级的轨道填入s电子,属于s区;具体又分为:
ⅠA族:1s1、2s1、3s1、4s1、5s1等
ⅡA族:1s2、2s2、3s2、4s2、5s2等。
图中第二纵列包括:2p、3p、4p、5p、6p…np等原子轨道。每个p轨道包含px、py、pz三种能级相同,但空间伸展方向不同的三重简并态轨道。每个简并原子轨道可以容纳2个电子,属于ns2np1、ns2np2、ns2np3、ns2np4、ns2np5、ns2np6电子排布区,称为p区,分别对应ⅢA→ⅦA、零族。
4.从构造原理图,可以分析元素周期律。
元素周期律就是元素性质(原子半径、电离能、电子亲合能、电负性、氧化数等 )的周期性变化。
构造原理是一个思维模型,是一个假想过程,依此划分能层、能级;能级组的划分是元素周期表划分周期的基础,是核外电子排布的主要依据;是用来帮助我们正确写出绝大多数元素原子核外电子排布式而设计的。核外电子的排布还需要遵守核外电子排布原则等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...