
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1) 等性杂化:
①概念:由不同类型的原子轨道“混合”起来,重新组合成一组完全等同的杂化轨道的过程称为等性杂化, 形成的轨道为等性杂化轨道。各个杂化轨道的形状和能量完全相同。
②条件:当成键原子中参与杂化的原子轨道上的电子数目等于杂化轨道数目,且与之成键的原子也完全相同, 其杂化就是等性杂化。例如,CH4和CCl4…与中心原子键合的是同一种原子,分子呈高度对称的正四面体构型, 其中的4个sp3杂化轨道自然没有差别,这种杂化类型叫做等性杂化。
(2) 不等性杂化
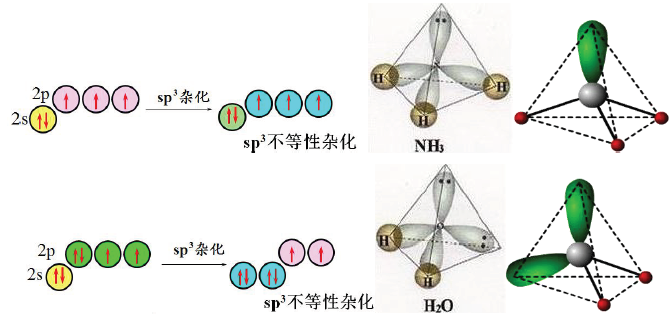
①概念:由不同类型的原子轨道“混合”起来,重新组合成一组不完全等同的杂化轨道(形成的杂化轨道的能量不完全相等,所含的成分也不完全相同)的过程称为不等性杂化,形成的轨道为不等性杂化轨道。参与杂化的原子轨道中存在孤对电子,则形成的杂化轨道的形状和能量不完全相同。
②条件
I、当成键原子中参与杂化的原子轨道上的电子数目等于杂化轨道数目,但是与之成键的原子不完全相同, 其杂化就是不等性杂化。例如,CHCl3和CH2Cl2…(另一种看法是:等性杂化并不表示形成的共价键等同。例如, CHCl3为变形四面体,分子中三个C-Cl键与C-H键并不等同,但C采取的杂化方式仍是sp3等性杂化。)
II、当成键原子中参与杂化的原子轨道上的电子数目多于杂化轨道数目,有的杂化轨道上必然会被孤对电子所占据,而被孤电子对占据的杂化轨道所含的 s 成分比单个电子占据的杂化轨道含的 s 成分略大,更靠近中心原 子的原子核,对成键电子对具有一定的排斥作用,参与成键杂化轨道具有更多的p轨道特征,此时,虽然与之成键的原子完全相同,其杂化就是不等性杂化。例如,H2O中的O、NH3分子中的N和CH4分子中的C 一样,采 取的是sp3杂化。但由于H2O、NH3分子中保留有孤对电子,四个杂化轨道中只有部分参与成键,为不等性杂 化,因此分子的形状是不对称的。(CH4分子中的键角109°28' NH3分子中的键角107°18' H2O分子中的键角 104°45')
判断是否等性杂化,要看各条杂化轨道的能量是否相等,不能看未参加杂化的轨道的能量。
H2O “V”字形,NH3和H3O+三角锥形,CHCl3和CH2Cl2、CH3Cl变形四面体形

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。我们从高中化学的角度来认识一下离子液体。想象一下,如果食盐(氯化钠)在室温下不是...
导语:想象一下,我们把原子看成是搭建豪宅(晶胞)的积木。当这些“原子积木”紧密堆...
离子液体(Ionic Liquids, ILs)是完全由离子构成、在室温或接近室温(通常≤100℃)...
在晶体分类体系中,除了分子晶体、共价晶体、金属晶体、离子晶体这四大基础类型外,还...
【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但...
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离...