
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题:醋酸在水中电离后的电离平衡常数为K,加入盐酸,氢离子浓度增加了,醋酸电离平衡逆向移动,使得醋酸电离程度改变,但是为什么加入盐酸前后醋酸的电离平衡常数不变?电离平衡常数不是表示电离程度吗?
分析:
1、逆向移动使得醋酸电离程度改变
这句话是对的
因为电离度(α)= (已电离弱电解质分子数/原弱电解质总的分子数), 平衡逆向移动电离的减少,分母不变 所以电离度(α)减小了。所以,弱电解质的电离平衡移动后,该弱电解质的电离度一定会改变!
2、既然醋酸的电离度改变,为什么平衡常数不变?
这个问题可以从以下两个方面分别理解:
第一 平衡常数是一个和温度压强相关的物理量 高中阶段我们仅认为和温度有关 所以你改变浓度对它没有影响
第二 平衡常数的表达式K=[CH3COO-]*[H+]/[CH3COOH] 现在平衡移动[H+]随着加盐酸在增大 ,平衡逆向移动[CH3COO-]减小[CH3COOH]在增加 现在你的平衡常数分子分母都在改变 你怎么能够判断最终K是增大的?还是减小的? 根据实验数据计算 事实上是不变的。
3、电离平衡常K和电离程度α的关系:
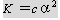 或
或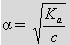
很显然
( 1 )浓度 c 固定时, α 随 K 的增大而增大,
( 2 ) T 一定, K 不变时,溶液越稀 α 越大。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶液中氢离子浓度([...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...