
|
学习小专题 |
【定义】系在一定温度下,可逆反应达到化学平衡状态时,生成物浓度的反应系数次幂的乘积与反应物浓度的反应系数次幂的乘积之比值,这个比值在一定温度下是个定值。
用浓度表示的平衡常数为:
式中[A]、[B]、[C]、[D]代表平衡体系中各组分的浓度。
也可用各组分的摩尔分数计算平衡常数,以Kx表示(X代表组分的摩尔分数):
对于有气体参加和生成的反应,也可用各组分的分压计算平衡常数,以Kp表示:
以上三种平衡常数可以进行如下换算:
式中R为气体常数、T为绝对温度、p为体系总压、△n=(g+h)-(a+b)。
【说明】
1. 表达式中各物质的浓度必须是平衡状态下的值,不能用任一时刻的浓度值。所以平衡常数Kc不随反应物或生成物浓度而变,但随温度的改变而政变。
2. 有气体参加的反应,可用气体分压的指数幂表示,写成Kp
3. 有固体物质参加的反应,固体浓度可以不写,因为分子间碰撞只能发生在固体表面,固体浓度可视为常数。稀溶液中的水分子浓度也可以不写。因为水的摩尔浓度是1000/18 = 55.5mol/L (稀溶液的密度近似等于1g/cm3),也是一个常数。
4. 化学平衡常数表达式跟反应方程式的书写形式有关。
5. 平衡常数K值的大小,表明反应进行的程度。K值越大,表示平衡时生成物浓度对反应物浓度的比越大,即反应进行得越完全,反应物的转化率越高。
6. 使用催化剂能改变化学反应速率,但不会使平衡移动,因此不会改变平衡常数。
【盖斯定律】1840年,盖斯(Гecc)在大量实验的基础上提出:“在等容或等压条件下,一个化学反应不管是一步完成还是分几步完成,其热效应总是相同的。”也就是说,在等容或等压条件下,反应热只与反应的始态和终态有关,而为反应的途径无关。盖斯定律的提出奠定了热化学的基础,它的重要意义在于可根据已经准确测定的反应热来计算难于测量的反应热的热效应。
【焓】体系的状态函数,用符号H表示。焓的定义式是:H=U+pV。U是体系的内能,p是体系压力,V是体积。在一定状态下,体系的焓应有一定值,但现在无法测定焓的绝对值,对热力学来说重要的是焓的变化值,这是可以通过实验测量的。
【焓变】体系终态的焓(H2)与始态的焓(H1)的改变量,用△H表示,△H=H2-H1。
【热效应】体系在一定温度下(等温过程)发生物理或化学变化时(在变化过程中只做膨胀功而不做其它功),所放出或吸收的热量。化学反应中的热效应又称反应热。根据化学热力学的分析,恒压下的反应热(又称恒压反应热)等于体系的焓变:△H=Qp,△H=(∑H)产物-(∑H)反应物。
【火焰】可燃性气体燃烧时所发生的现象。是燃烧的一种特殊情况,火焰是指气态可燃物在燃烧时形成的一个发光、放热的区域。液态或固态可燃物在燃烧时,如能先变成气体,燃烧时也会有火焰生成。
火焰可分为三个部分:
(1)内层,带蓝色,因供氧不足,燃烧不完全,温度低,有还原作用,称为内焰或还原焰;
(2)中层,明亮,温度较内层高;
(3)外层,无色,因供氧充足,燃烧完全,温度最高,有氧化作用,称为外焰或氧化焰。
对有灯芯的火焰,如蜡烛和酒精灯火焰则可分为:
(1)焰心,中心黑暗部分,由能燃烧但还未燃烧的气体(蒸气)所组成;
(2)内焰,包围焰心的最明亮部分,是气体未完全燃烧的部分,含有碳粒子(或其它固体粒子),被灼热发出强光,并有还原作用,也称还原焰;
(3)外焰,最外面几乎无光的部分,是气体完全燃烧的部分,含有过量而强热的空气,有氧化作用,也称氧化焰。
【爆炸极限】指一种可燃气体、蒸气或粉末和空气的混和物能发生爆炸的浓度范围。
例如空气中混有氢气、汽油蒸气、面粉等时,在一定浓度范围内,遇到火花就会使火焰蔓延而发生爆炸。其最低浓度称为下限(或低限),最高浓度称为上限(或高限),浓度低于或高于这一范围,都不会发生爆炸。爆炸极限通常用可燃性物质在爆炸混和物中体积百分比表示,例如氢气的爆炸极限为4.1~74.2%,4.1%为下限,74.2%为上限。有时也用每立方米混和物中所含可燃性物质的质量(克)来表示,这种表示方法,大多用于可燃性粉尘的爆炸极限,例如铝粉的爆炸极限为40克/米3 ,这是铝粉的爆炸下限,一般不计可燃性粉尘的爆炸上限。
【定义】
1.标明伴随化学反应放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示化学反应和热效应关系的化学方程式,叫做热化学方程式。
例如:
2H2(气)+O2(气)=2H2O(气);ΔH=-483.6千焦/摩尔
2H2(气)+O2(气)=2H2O(液);ΔH=-517.6千焦/摩尔
【说明】
书写热化学方程式时应注意:
①热化学方程式的系数只表示各反应物和生成物的物质的量,不表示微粒数,必要时,系数可用分数表示。
②化学反应的热效应与反应物和生成物的状态有关(如上例),书写时必须将每种物质的状态注在化学式后面。
③ΔH为焓变,如果放热用“-”表示,吸热用“+”表示;数值的多少必须与化学方程式中所表示的物质的量对应。
④化学反应的热效应还与外界条件有关,应在方程式的等号上注明温度和压强。若不注明,则表示温度为298K、压强为1.013×105 帕。
【有效碰撞理论】有关反应速度的理论,是在气体分子运动论的基础上提出的。此理论的要点是:在气体反应中,化学反应发生的先决条件是反应物分子必须发生碰撞;但不是任何两种反应物分子之间的碰撞都能发生反应,只有少数分子的碰撞能发生反应,这种能够发生反应的碰撞称为有效碰撞。能发生有效碰撞的分子所具有的能量比整个体系内分子的平均能量要高出很多,才能发生有效碰撞。因此化学反应的速度主要取决于单位时间内有效碰撞的次数。
【催化剂中毒】反应体系中含有少量杂质就能严重降低甚至完全破坏催化剂的活性,这种物质称为催化剂毒物,这种现象称为催化剂中毒。催化剂中毒现象有两类:
(1)暂时性中毒(或称可逆性毒化),如合成氨生产中的O2、H2O(气)、CO、CO2等杂质引起的中毒。只要不断用纯净的原料气吹过中毒的催化剂表面,就可使毒物除去。
(2)永久性中毒(或称不可逆毒化),如合成氨生产中的含硫化合物及PH3等属于永久毒物。这主要是因为这类毒物与催化剂表面形成了牢固的表面化合物。
【定义】在反应物或催化剂里混有少量物质,使催化剂的催化能力急剧降低甚至丧失,这种现象叫催化剂中毒。例如,在合成氨原料气中含有CO、CO2以及H2S、PH3、水汽等杂质,能使铁触媒中毒;接触法制硫酸中,如果有砷和硒的氧化物(As203、Se02)等,能使钒触媒丧失活性。因此,必须净化原料气,防止催化剂中毒,还可以减轻对设备的腐蚀。
【同离子效应】在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,而使弱电解质电离度减小的效应。例如浓度为0.1mol/l的醋酸(CH3COOH)溶液的电离度是1.33%,若加入醋酸钠(CH3COONa)晶体使溶液中醋酸钠浓度为0.1mol/l,此时醋酸的电离度降为0.018%。这是由于醋酸钠是强电解质在溶液中电离出大量的CH3COO- 离子,使醋酸的电离平衡向形成醋酸分子一方移动的结果。在同离子效应发生的同时,也存在着盐效应,但盐效应对电离度的影响比同离子效应要小得多。
【定义】在弱电解质溶液中加入跟该电解质有相同离子的强电解质,可以降低弱电解质的电离度,这种叫做同离子效应。
【说明】
1.在弱酸溶液中加入该酸的可溶性盐(如在醋酸溶液中加入少量固体醋酸钠),或在弱碱溶液中加入该碱的可溶性盐(如在氨水中加入氯化铵),都会发生同离子效应。
2.发生同离子效应的原理主要是加入相同离子后,使原电解质的电离平衡向生成原电解质分子的方向移动,从而降低原电解质的电离度。
3.在电解质饱和溶液中加入跟该电解质有相同离子的强电解质,从而降低原电解质的溶解度,这种现象也叫同离子效应。这是因为增加溶液中离子的浓度,使有关离子浓度的乘积超过原电解质的溶度积常数,使原电解质沉淀下来。
4.在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,而使弱电解质电离度减小的效应。例如浓度为0.1mol/l的醋酸(CH3COOH)溶液的电离度是1.33%,若加入醋酸钠(CH3COONa)晶体使溶液中醋酸钠浓度为0.1mol/l,此时醋酸的电离度降为0.018%。这是由于醋酸钠是强电解质在溶液中电离出大量的CH3COO- 离子,使醋酸的电离平衡向形成醋酸分子一方移动的结果。
【定义】用来衡量化学反应进行的快慢程度,常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,单位是摩/升•分 或摩/升•秒。
【说明】
1. 对同一反应,选甩不同物质的浓度变化来表示反应速率时,数值可能不同,因此必须标明物种。例如,反应2N205 = 4N02 + 02,可以用v(N2O5)或v(N02)、v(02)等来表示。反应时各反应物和生成物的浓度有一定的比,所以只需要选用任一物质的浓度变化来表示,因为各种物质表示的反应速率彼此之间可以换算,例如 v(NO2) =2v(N2O5)。
2. 在反应时反应物和生成物的浓度都在不断变化,反应速度也随着改变,所以必须指明某一时刻的速率才有意义,这叫瞬时速率。实际上用的都是在一段时间内的平均速率。
3.化学反应速率的大小、取决于反应物本身的性质。例如,燃烧、爆炸、离子反应等都能在短时间内完成;而有机反应,特别是高分子化学反应,所需时间往往很长。它还跟物质的浓度、压强、反应温度、催化剂、光、介质、反应物表面状态、扩散等很多因素有关。 在化工生产中常用控制反应条件来增大反应速率。
【质量作用定律】由挪威化学家葛尔德保(Guldberg)和威吉(Waage)首先提出。原意是:当温度恒定时,在均相系中,化学反应的速度和反应物的有效质量成正比(有效质量应理解为浓度)。现代对质量作用定律的认识是:在恒温下,对简单反应(或复杂反应中的任一基元反应)来说,化学反应的速度和反应物浓度的方次的乘积成正比(反应物浓度方次的数值等于反应式中各分子式前边的系数)。
【定义】在一定条件下,基元反应的速率跟反应物浓度的指数幂的乘积成正比。
【说明】
1. 有元反应(曾用名:基元反应)aA + bB ==gG + hH,它的 反应速率公式可表示为:v =k[A]m [B]n
上式中[A]、[B]分别表示反应物A和B的浓度,m + n是反应的级数,k是反应速率常数,它在数值上等于单位浓度时的反应速率。不同反应的k值不同。同一反应的k值,跟反应温度、催化剂等因素有关,而跟反应物浓度、压强无关。
2. 由反应物分子(或离子、原子、自由基等)直接作用而生成新产物的反应,叫做元反应。简单反应只包含一种元反应,因此可直接应用质量作用定律。在复合反应中,不是所有反应物分子都直接作用,所以质量作用定律不能直接应用于复合反应,然而对于组成复合反应的任何一步元反应,质量作用定律依然适用。
3. 由质量作用定律可知,简单反应的反应级数跟它相应的元反应的反应分子数相同。但对复杂反应来说则不同。例如,
反应 2H2(气)+2NO (气)=2H20+N2 (气),实验证明它是分两步进行的。
2NO + H2 = H202+N2 (慢反应)
H2O2 + H2 = 2H2O (快反应)
整个反应的速率由最慢的一步决定,它的质量作用定律表示式是 V =k[H2][NO]2 ,可见这是一个三级反应,而不是四级反应。
【定义】反应中能量较高的、能发生有效碰撞的分子,叫做活化分子。
【说明】
1. 不是反应物分子之间的任何一次直接作用都能发生反应, 只有那些能量相当高的分子之间的直接作用才能发生反应。在一 定温度下,某反应具有的活化分子数由该反应的活化能Ea决定。 根据玻耳兹曼能量分布定律可知,能量大于Ea的分子占总分子数中的分数可用 估算。例如,在25°C发生的某反应,活化能Ea是83. 68kJ/mol,则
估算。例如,在25°C发生的某反应,活化能Ea是83. 68kJ/mol,则  = 2. 15 × 10 一15 = Ni/N 这就是说,在4. 65×1014(=l/2.15×10—15)个分子中只有一个是活化分子。
= 2. 15 × 10 一15 = Ni/N 这就是说,在4. 65×1014(=l/2.15×10—15)个分子中只有一个是活化分子。
2. 活化分子数(或浓度)是决定化学反应速率的重要因素。 对某一给定的化学反应,当温度(T)升高时, 的值增大,活化分子所占的比例增大,反应速率也就增大。
的值增大,活化分子所占的比例增大,反应速率也就增大。
3. 使用催化剂能,低反应活化能,使得具有平均能量的反应物分子只要吸收较少的能量就能变成活化分子,有利于增大化学反应速率。
【活化能】活化能是化学动力学中的一种重要概念,1889年由瑞典物理化学家阿累尼乌斯(Arrhenius)首先提出。阿累尼乌斯总结了大量的实验数据,提出了经验公式
式中K为速度常数,A为一常数通常称为“指前因子”或“频率因子”,R为气体常数,T为热力学温度,而Ea即为活化能。活化能的意义是:活化分子的平均能量与反应物分子平均能量之差。
在过渡状态理论中,活化能(能垒)是指反应物分子和活化络合物分子处于基态时的位能差,它不等于Ea。
【定义】
1.对元反应来说,阿伦尼乌斯公式中的活化能(Ea)是活化分子的平均能量跟所有分子的平均能量的差。
2.碰撞理论认为,分子碰撞的剧烈程度不取决于A、B两个分子的总移动能,而取决于它们在质心连线方向上的相对移动能。 只有这个能量超过某一数值(叫临界能)时反应才能发生,碰撞理论就把临界能×NA=Ec做反应活化能(NA是阿佛加德罗常数)。
【说明】
1. 关于活化能定义目前还没有完全统一的提法,随着反应速 率理论的发展,人们对这概念的理解在不断深化。
2. 反应活化能的大小由反应物分子性质所决定,也就跟分子的内部结构密切相关。
3. 不同反应有不同的活化能(Ea),Ea越低,反应进行得越快。在通常反应温度下,大多数反应的活化能在40〜400kJ/mol 范围内。一般的中和反应Ea<40kJ/mol,所以中和反应速率很大,用通常的方法难以测定。
4. 活化能的实验测定常用阿伦尼乌斯公式的不定积分形式求得
lnk=—Ea/RT+B ,
只要测得几个不同温度下的反应速率常数k,以lnk对1/T作图,得到一条直线,由它的斜率一Ea/R就可求得活化能Ea=-(斜率)×R(R是气体常数)。
【催化剂】能改变化学反应速度而在反应前后本身的化学组成、化学性质及数量没有变化的物质称为催化剂。正催化剂能加快反应速度,负催化剂(阻化剂)能减慢反应速度。
【催化剂的选择性】催化剂的选择性有两方面的含义:
(1)不同类型的反应需要选择不同的催化剂;即便是同一类型的反应,使用的催化剂也不一定相同,如SO2的氧化用的是V2O5催化剂,而乙烯氧化却用金属Ag催化剂。
(2)对相同的反应物,如果选用不同的催化剂,可以得到不同的产物,例如乙醇的分解:
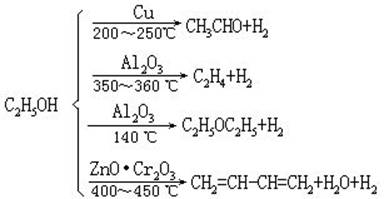
从热力学观点分析,以上的反应都能自发地进行,某种催化剂只对某一特定反应有催化作用,并不能加速所有可能发生的反应。
【催化剂中毒】反应体系中含有少量杂质就能严重降低甚至完全破坏催化剂的活性,这种物质称为催化剂毒物,这种现象称为催化剂中毒。催化剂中毒现象有两类:
(1)暂时性中毒(或称可逆性毒化),如合成氨生产中的O2、H2O(气)、CO、CO2等杂质引起的中毒。只要不断用纯净的原料气吹过中毒的催化剂表面,就可使毒物除去。
(2)永久性中毒(或称不可逆毒化),如合成氨生产中的含硫化合物及PH3等属于永久毒物。这主要是因为这类毒物与催化剂表面形成了牢固的表面化合物。
【定义】能改变化学反应速率而它本身的化学组成和质量在反应前后保持不变,这种物质叫做催化剂。催化剂在反应中所起的作用叫催化作用。
【说明】
1.催化剂能增大或减小化学反应的速率。能增大反应速率的叫正催化剂,例如,接触法制造硫酸使用V2O5,合成氨工业中使用铁触媒等。减小反应速率的叫负催化剂(或叫抑制剂),例如橡胶、塑料制品中的防老剂。食用油脂里加入没食子酸正丙酯,能防止酸败,这是负催化剂的一个例。
2. 催化剂只能改变反应的速率,不能使原来不能发生的反应得以进行。在可逆反应中催化剂只能缩短反应达到平衡的时间, 而不能使化学平衡发生移动。
3. 催化剂一般有选择性,不同的化学反应要选用不同的催化剂。同样的反应物选用不同的催化剂,可以发生不同的反应,从而得到不同的产物。
4. 催化剂有一定的活化温度,在这个温度范围内使用,催化剂的活性最高。
5. 使用催化剂能增大反应速率的机理主要是形成中间产物, 或在催化剂表面的活性中心发生反应,从而改变反应的途径,使反应活化能降低。
【定义】在同一条件下,既能向正反应方向进行,又能向逆反应方向进行,这种反应叫做可逆反应。
【说明】
1. 严格说来,几乎所有的化学反应都是可逆的,但各种化学 反应的可逆程度有很大差别。例如,由H2和F2合成HF,由Ag+ 和Cl-生成氯化银沉淀,这些反应的可逆程度较小,可看作是不可逆或单向反应。
2. 可逆反应在密闭,容器中进行,任何一向反应都不能进行到底,最后达到化学平衡状态。
3. 可逆反应A B的动力学特征是物质A的浓度随反应时间的增长不可能降低到零,而物质B的浓度亦不可能增加到A的起始浓度。分子重排和异构化反应是这类可逆反应的最简单例子。
B的动力学特征是物质A的浓度随反应时间的增长不可能降低到零,而物质B的浓度亦不可能增加到A的起始浓度。分子重排和异构化反应是这类可逆反应的最简单例子。
【定义】在可逆反应中,正逆反应的速率相等,反应物和生成物的浓度不再随时间而改变,这种状态叫做化学平衡。
【说明】
1. 在一定条件下,可逆反应无论从正反应开始,或是从逆反应开始,最后都能达到平衡状态。
2. 在一定条件下,平衡状态是在该条件下化学反应进行的最大限度。这时,表面看来,反应似乎已经停止,但实际上正、逆反应仍在继续进行,只不过两者的速率相等,所以化学平衡是动态平衡,反应物和生成物浓度保持相对恒定。
3.化学平衡是可逆反应体系中的一种特殊状态,是暂时的。
当外加条件(如温度、压强、浓度等)改变时,平衡就会相应改变,发生平衡移动,直到建立新的平衡状态。
【定义】可逆反应达到平衡状态时,指定反应物消耗掉的量跟反应开始时投入的量的比,用百分数表示,叫做该原料反应物的转化率。或写成
某指定反应物的转化率==(该反应物起始浓度一该反应物的平衡浓度)÷ 该反应物的起始浓度
【说明 】
1. 反应转化率跟化学平衡常数一样,也能表示反应进行的程度。转化率越大,表示反应进行得越完全。
2. 在同一反应中,各种反应物的转化率不同,即使同一反应物,如果各反应物浓度配比不同,它的转化率也不同。
3.工业生产上常用改变反应物浓度、压强、温度等措施提高反应物的转化率。
【定义】一个可逆反应在达到平衡状态后,当温度、压强、浓度 等外界条件改变时,会使反应由该平衡状态向另一个新的平衡状态转化,这种变化叫做化学平衡的移动。
【说明】
1. 改变外界条件对正、逆反应速度的影响不同,从而使化学 平衡发生移动。当v正>v逆时,平衡向正反应方向移动,否则向逆反应方向移动。
2. 影响化学平衡的主要外界条件是浓度、压强和温度。
(1) 浓度当其他条件不变时,增大反应物浓度或减小生成物的浓度,都使反应向正方向移动,否则向逆反应方向移动。
(2) 压强反应前后气态物质总体积(或物质的量)发生变化的反应,在恒温下增大压强,会使平衡向气态物质体积缩小的方向 移动。反应前后总体积不变的可逆反应,或平衡混合物中各组分 都是固体或液体的,改变压强,不会使平衡移动。
(3) 温度升高温度,平衡向吸热反应方向移动;降低温度, 向放热方向移动。
3. 催化剂以同样程度影响V正和V逆,它只能缩短达到平衡所需的时间,并不影响平衡的移动。
【勒沙特列原理】又称平衡移动原理。1887年由法国化学家勒沙特列(Le chatelier)提出。其内容是:如果改变影响平衡的一个条件(如浓度、压力、温度等),平衡就向能够减弱这种改变的方向移动。比如,在温度、压力不变的条件下增加反应物的浓度或减少生成物的浓度,平衡朝正反应方向移动;在温度不变的情况下,对反应前后分子数有变化的气体反应,增大压力,平衡朝分子数减少的方向移动;在其它条件不变时,升高温度,平衡就朝吸热反应方向移动。勒沙特列原理在生产上有广泛的应用,利用这一原理选择适当的反应条件,可以提高产率、降低成本。
【定义】可逆反应只有在一定条件下保持相对的、暂时的平衡状态。当改变一种外界条作(如浓度、压强、或温度等)时,平衡就被打破,并向能够减弱这种改变的方向移动,这就是勒夏特列 (Henry Louis Le Chatelier, 1850—1936)原理。
【说明】
1.勒夏特列原理(曾用名:平衡移动原理)是自然界的普遍规律。它可以解释各类化学平衡的移动(如沉淀-溶解平衡、电离平衡、络合平衡等),也适用于物理平衡。例如水的三态变化,升高温度,平衡向吸热方向移动,有利于水蒸发为气态;降低温度,平衡向放热方向移动,有利于水凝固成冰。
2.这个原理只能应用于平衡系统,不适用于非平衡系统。
【定义】能代表反应机理的, 由反应物微粒(分子、原子、离子、自由基等)一步直接实现的变化, 称为基元反应或基元步骤。例如 NO2+CO→NO+CO2
大多数化学反应不是基元反应, 有不少是由多个基元反应组成的, 例如H2(气)与I2(气)化合的反应是由两个基元步骤完成的:
I2=2I H2+2I→2HI
【说明】
1、从微观上看,反应物分子一般总是经过若干的简单反应步骤,才最后转化为产物分子的。每一个简单的反应步骤,就是一个基元反应。基元反应步骤要求反应物一步变成生成物,没有任何中间产物。按照基元反应定义,所有的可逆反应均为非基元反应
2、基元反应的动力学规律符合质量作用定律,即:基元反应的化学反应速率与反应物的浓度数值相应方次乘积成正比;其方次即为各物质前面系数,均取正值。
3、基元反应方程式中各反应物分子数之和称为反应分子数,按照反应分子个数可将基元反应划分为单分子反应、双分子反应和三分子反应,具体如下:
(1)单分子反应
方程式:A→产物
(2)双分子反应
方程式:A+B→产物或者 2A→产物
(3)三分子反应
方程式:A+B+C→产物或者2A+B→产物或者A+2B→产物
【化学反应速率常数】反应速率方程式中的比例常数k叫做化学反应速率常数。例如有以下简单反应:aA+bB→gG+hH,其中a、b为反应级数,取决于反应机理,可由实验测得。
用A物质浓度变化率表示反应速度时: νA=kA[A]a [B]b
用B物质浓度变化率表示反应速度时: νB=kB[A]a [B]b
kA与kB有如下关系:kA/kB=a/b。
如果上述反应是气相反应, 则反应速度方程式中各物质的浓度可以换成分压, 那么式中的k值也要相应地改变。
对不同的反应, k值是不同的。对某指定的反应, k值与反应物的浓度无关而与反应温度及使用的催化剂有关。
【说明】
1、1889年,阿伦尼乌斯通过大量实验与理论的论证揭开了反应速率常数对温度的依赖关系。
阿伦尼乌斯公式(Arrhenius equation )是由瑞典的阿伦尼乌斯所创立的化学反应速率常数随温度变化关系的经验公式。公式写作 k=Ae-Ea/RT (指数式)。k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子(也称频率因子)。
2、K值的大小反映出反应的本性,因为它是表示单位浓度的反应速度,所以在相同条件下,K的大小反映反应速率的快慢。
3、K值的大小与浓度无关,浓度的大小能影响化学反应速率的大小,但对速率常数没有影响。
4、K值随温度升高而增大,这与平衡常数不同,速率常数对温度非常敏感,每升高10度,速率会增加2-4倍。
【闪点】又称内燃点。表示可燃性液体性质的指标之一。是液体表面的蒸气和空气的混和物与火接触初次发生蓝色火焰闪光时的温度。用标准仪器测定闪点,仪器有开杯式和闭杯式两种,一般前者用于测定高闪点液体的闪点,后者用于测定低闪点液体的闪点。闪点比着火点的温度低些。可燃性液体的闪点和着火点表示其发生爆炸或火灾的可能性大小,这对可燃性液体的运输、储存和使用的安全等有极大的关系。
【熵】体系的状态函数,是体系内部质点混乱程度(或无序度)的量度,常用S表示。当体系内质点的聚集状态发生改变时,其熵值就会改变,体系终态熵值(SB)与体系始态熵值(SA)之差为体系的熵变,用△S表示,△S=SB-SA。化学反应的熵变等于生成物的熵值与反应物的熵值之差,△S=(ΣS)生成物-(ΣS)反应物。
【吉布斯自由能】体系的状态函数,常用符号G表示,G=△H-T△S,自由能也称自由焓或吉氏函数。体系的自由能改变△G,为体系终态的自由能与始态的自由能之差。在等温等压条件下,体系的自由能减少等于体系所做的最大有用功。
对等温等压条件下发生的化学反应,可以根据反应的自由能变[△G=(ΣG)产物 -(ΣG)反应物],判断反应能否自发进行:
当△G<0,反应发生时会放出自由能,可被利用来对环境做有用功,这个反应就能自发进行;
当△G>0,必须由环境提供有用功反应才能发生,这个反应就是非自发的;
当△G=0,则反应体系处于平衡状态。
【热力学第一定律】即能量守恒和转换定律。可以这样表述:
(1)不供给能量而可连续不断产生能量的机器叫第一类永动机,第一类永动机是不可能存在的。
(2)在体系状态变化过程中,它的内能改变等于在这个过程中所做的功和所传递的热量的总和。当某体系的状态改变时,假设体系吸收的热量为Q焦耳,同时对环境做了W焦耳的功,根据热力学第一定律,应有下面的公式:△U=Q-W。
【热力学第二定律】是热力学的基本定律之一,有多种表述方式:
(1)热量总是从高温物体(体系)传到低温物体,不能自发地进行相反的传递。
(2)功可以全部转化为热,但任何热机不能全部地、连续地把所获得的热量转变为功。
(3)在任何自发过程中,体系和环境的总熵值是增加的。热力学第二定律所要解决的中心问题是自发过程的方向和限度。
【热力学第三定律】当体系的热力学温度趋于零时,混乱度为最小,此时体系的熵值也趋于零。也可以说,在绝对零度时,任何纯物质的完美晶体的熵值都等于零。有了热力学第三定律,从原理上说,纯物质的绝对熵值的求算问题就可以认为是解决了。
【分压】即分压力。恒温时混和气体中某组分气体单独占有与混和气相同的体积时,对容器所产生的压力。混和气的总压就等于各组分气体的分压之和。
【道尔顿分压定律】1807年由道尔顿(Dalton)首先提出。内容是:混和气体的总压力等于各组分气体的分压力之和。由此可进一步得出:某组分气体分压的大小和它在混和气中的体积分数(或物质的量分数)成正比,等于混和气体的总压乘以该组分的物质的量分数。这个定律的数学表达式为:
P总=P1+P2+P3+……+Pi
Pi=p总×Xi(Pi为某组分的分压,Xi为该组分的物质的量分数)。
【过渡状态理论】也是一种有关反应速度的理论,是在统计力学和量子力学的发展中建立起来的。该理论的大意是:由反应物到产物必须经过一种过渡状态,即具有足够能量的反应物分子形成活化络合物的中间状态,反应物和活化络合物之间很快达到平衡,化学反应的速度由活化络合物的分解速度来决定。例如A原子和BC分子间的简单反应:
当A原子沿B—C轴线逐渐接近BC分子时,B—C间的化学键逐渐松弛,同时开始逐渐形成新的A—B键,在此过程中体系的位能增加,当形成过渡状态的活化络合物[A…B…C]≠ 时,体系的位能最高,活化络合物很不稳定,它可能分解变为产物,也可能重新变回反应物。由反应物变成活化络合物及由活化络合物变回反应物的速度都很快,在瞬间就能达到平衡,而由活化络合物分解变成产物的速度却是比较慢的,因此化学反应的速度取决于活化络合物分解的速度。
【催化剂选择性】催化剂的选择性有两方面的含义:
(1)不同类型的反应需要选择不同的催化剂;即便是同一类型的反应,使用的催化剂也不一定相同,如SO2的氧化用的是V2O5催化剂,而乙烯氧化却用金属Ag催化剂。
(2)对相同的反应物,如果选用不同的催化剂,可以得到不同的产物,例如乙醇的分解:

从热力学观点分析,以上的反应都能自发地进行,某种催化剂只对某一特定反应有催化作用,并不能加速所有可能发生的反应。