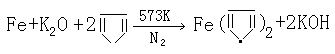|
一: 物理性质 铁是具有白色光泽的金属,铁略带灰色。它的密度都较大,熔点也较高,有很好的延展性。此外,它有很强的铁磁性,并有良好的可塑性和导热性。 二: 化学性质 1。与非金属的反应 2。与水蒸气的反应 在高温下,铁与水蒸气作用生成Fe3O4: 铁在潮湿空气中会生锈,生成一种松脆多孔的物质-铁锈,其成分比较复杂,通常简略用Fe2O3·xH2O表示。
2Fe + 4CO2 + O2 + 2H2O
4Fe(HCO3)2 + O2 + 2(x-2)H2O
3。与酸和碱的反应 常温时,铁和铝、铬一样,与浓HNO3不起作用,这是因为在铁的表面生成一层保护膜,使铁“钝化"。因此,贮运浓HNO3的容器和管道也可用铁制品。浓H2SO4在常温时也能使铁钝化,故可用铁桶盛H2SO4。但稀的无机酸,稀HNO3都能溶解铁。铁能被浓碱溶液所侵蚀,生成Fe(Ⅲ)的化合物Fe(OH)3或[Fe(OH)6]3-离子.
Fe + 2HCl
2Fe + 6HNO3(稀)
一: FeO 由铁(Ⅱ)的草酸盐在隔绝空气的条件下加热或用氢气高温还原Fe2O3均可制得氧化亚铁FeO:
FeC2O4
Fe2O3 + 2H2 氧化亚铁为黑色固体, 显碱性, 能溶于酸性溶液中,但一般不溶于水或碱性溶液中。 二:Fe2O3 加热FeSO4或Fe(OH)3可制得暗红色的Fe2O3。
2FeSO4
2Fe(OH)3 Fe2O3具有α和γ两种不同构型,α型是顺磁性的,而γ型是铁磁性的。自然界存在的赤铁矿是α型。如将硝酸铁或草酸铁加热,可得α型Fe2O3。将Fe3O4氧化则得到γ型的Fe2O3。γ型Fe2O3在673K以上转变成α型。三氧化二铁可以用作红色颜料,磨光粉以及某些反应的催化剂。 在醋酸纤维或氯化乙烯的基底上,以氯化乙烯-醋酸乙烯共聚物或苯乙烯-丁二烯共聚物为粘合剂,把γ-Fe2O3涂上去,可制做录音磁带。在磁带上所用的磁性体是硬磁性体,主要是针状γ-Fe2O3和含钴的针状Fe2O3、针状的Fe3O4等物。 三:Fe3O4
铁除了上述的FeO和Fe2O3外,还能形成Fe3O4,又称磁性氧化铁。在Fe3O4中的Fe具有不同的氧化态,过去曾认为它是FeO和Fe2O3的混合物。但经X射线研究证明,Fe3O4是一种反式尖晶石构,可写成FeⅢ[(FeⅡFeⅢ)O4]。
在铁(Ⅱ)的盐溶液中加入碱,即得到Fe(OH)2。
但因Fe(OH)2易被空气中的氧所氧化,往往得不到白色的Fe(OH)2,而是变成灰绿色,最后成为棕红色的Fe(OH)3。
碱作用于铁(Ⅲ)盐溶液,也可析出Fe(OH)3。它略有两性,但碱性强于酸性,只有新沉淀出来的Fe(OH)3能溶于浓的强碱溶液中。如热的浓氢氧化钾溶液可溶解Fe(OH)3而生成铁(Ⅲ)酸钾(KFeO2或K3[Fe(OH)6])。 Fe(OH)3溶于盐酸中,仅发生中和反应:
Fe(OH)3 + 3HCl
硫酸亚铁是比较重要的亚铁盐。将铁屑与稀硫酸反应,然后将溶液浓缩,冷却后就有绿色的FeSO4·7H2O晶体析出,俗称绿矾。
6FeSO4+K2Cr2O7+7H2SO4
硫酸亚铁在空气中不稳定,易被氧化成铁(Ⅲ)盐,但硫酸亚铁与碱金属或铵的硫酸盐形成的复盐M2SO4·FeSO4·6H2O在空气中比硫酸亚铁稳定得多。最重要的复盐是硫酸亚铁铵,俗称摩尔盐,分子式为(NH4)2SO4·FeSO4·6H2O,是分析化学中常用的还原剂。
铁(Ⅲ)盐中,三氯化铁比较重要。 一:物理性质 二:化学性质 (1)铁(Ⅲ)盐的水解
从水解平衡式可以看出,当向溶液中加酸,平衡向左移动,水解度减小。当溶液的酸性较强时(pH<0),Fe3+主要以淡紫色的[Fe(H2O)6]3+离子存在。如果使pH提高到2~3时,水解趋势就很明显,聚合倾向增大,溶液颜色为黄棕色,随着pH继续升高,溶液由黄棕色逐渐变为红棕色,最后析出红棕色的胶状Fe(OH)3(或Fe2O3.nH2O)沉淀。 (2)杂质铁离子的去除 2Fe(OH)SO4+2Fe2(OH)4SO4+Na2SO4+2H2O (3)铁(Ⅲ)离子的氧化性 铁盐在酸性溶液中是较强的氧化剂,可以将I-氧化成I2,将H2S氧化成S,还可被SnCl2还原:
2Fe3+ + 2I-
2Fe3+ + H2S
2Fe3+ + SnCl2 另外,FeCl3的溶液还可以溶解Cu:
2FeCl3 + Cu (4)Fe3+,Cr3+,Al3+的类似性 由上述Fe3+离子的性质可以看出,它和前面学过的Cr3+、Al3+有许多类似之处。主要表现在:在水溶液中都是含有6个水分子的水合离子[M(H2O)6]3+;都容易形成矾;遇适量的碱都生成难溶的胶状沉淀。这和它们的电荷相同,半径相近有关。但是,由于离子的电子层结构不同,它们之间又有差异。如水合离子的颜色不同;Al(OH)3和Cr(OH)3显两性,而Fe(OH)3主要显碱性;Cr3+和NH3可形成配合物,而Al3+和Fe3+在水溶液中不易形成氨配合物等等。这三种离子的类似性使它们在矿物中常常共存;它们的差异性常被利于这些元素的分离。
Fe3+离子与S2-离子作用的产物,与溶液的酸碱性有关。当Fe3+与(NH4)2S(或Na2S)作用时,生成Fe2S3黑色沉淀,而不是Fe(OH)3沉淀,这是因为Fe2S3比Fe(OH)3难溶(Ksp,Fe2S3=1×10-88,Ksp,Fe(OH)3=1×10-38)之故。如将该溶液酸化,就不会出现Fe2S3沉淀,而得到浅黄色的硫,铁以Fe2+离子的形式存在于溶液中。
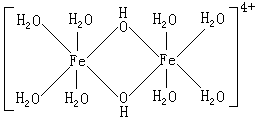
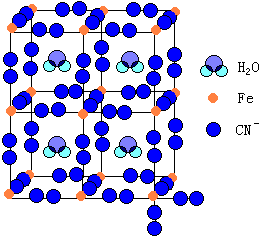
一:氨配合物 Fe2+和 Fe3+遇氨水是不能获得它们的氨配合物, 而是得到相应的Fe(OH)2[立即被空气中的氧氧化成Fe(OH)3]和Fe(OH)3沉淀。 虽然在无水状态下FeCl2可以与NH3形成[Fe(NH3)6]Cl2,但它遇水即按下式分解。 二:硫氰配合物 在Fe3+离子的溶液中,加入硫氰化钾或硫氰化铵,溶液即出现血红色: Fe2+与SCN-形成的配合物不稳定。 三:氰配合物 使亚铁盐与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解。 近来根据单晶X射线实验数据提出了不同的解释,认为在普鲁士蓝中所有的FeⅢ和FeⅡ位于立方体的角(如图14-4),但有四分之一[FeⅡ(CN)6]4-的位置被水分子占据。
Fe3+和[Fe(CN)6]4-,Fe2+与[Fe(CN)6]3-的反应,常分别用于鉴定Fe3+和Fe2+离子。普鲁士蓝主要用于油漆和油墨工业,也用于制蜡笔、图画颜料等。
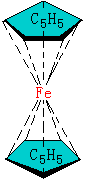
五:二茂铁
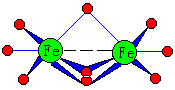
Fe(C5H5)2经X射线证明,其结构为夹心式的,如图14-7。 |