|
锰是灰色具有铁外观的金属,纯锰为银白色,质地较软,但当含有杂质时,锰颜色加深且硬而脆。锰有三种晶型,常温-973K为α型,结构复杂,每个晶胞中含58个原子。973K以上稳定的是β型,晶胞内含20个原子,结构尚不清楚。1343~1433K稳定的是属面心四方晶格的锰,冷后逐渐转为α型。
锰是活泼金属,块状锰在空气中放置会因氧化作用很快失去光泽,粉末状锰在空气中迅速氧化,甚至可燃烧生成Mn3O4。
3Mn + 2O2 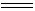 Mn3O4
Mn3O4
Mn3O4类似于Fe3O4,可以认为是[MnⅡ(Mn2ⅢO4)]的化合物。
锰能缓缓与冷水作用并释放出氢气。
Mn + 2H2O
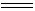 Mn(OH)2 +
H2↑ Mn(OH)2 +
H2↑
锰能与稀酸作用放氢,锰也能和氧化性酸相作用生成锰盐。加热时锰能与许多非金属如S、C、Si、N2及P等形成化合物。
锰也能与熔碱反应生成锰酸盐,如
2Mn + 4KOH + 3O2
 2K2MnO4 +
2H2O 2K2MnO4 +
2H2O

Mn2+在酸性介质中比较稳定,要将它氧化成MnO4-是很困难的,只有在高酸度的热溶液中,与强氧化剂反应,例如,过硫酸铵(ψθS2O82-/SO42-=2.01V)或二氧化铅(ψθPbO2/Pb2+=1.46V)等才能使Mn2+氧化成MnO4-离子。
2Mn2+ + 5S2O82-
+ 8H2O 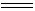 16H+ + 10SO42- +
2MnO4-
16H+ + 10SO42- +
2MnO4-
2Mn2+
+ 5PbO2 + 4H+ 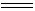 2MnO4- +
5Pb2+ + 2H2O
2MnO4- +
5Pb2+ + 2H2O
在碱性介质中Mn2+却易被氧化。
MnO2 +
2H2O + 2e-  Mn(OH)2 + 2OH- ψθB=-0.05V
Mn(OH)2 + 2OH- ψθB=-0.05V
O2 +
2H2O + 4e-  4OH- ψθB=0.401V
4OH- ψθB=0.401V
例如,向锰(Ⅱ)盐溶液中加人强碱,可得到白色的Mn(OH)2沉淀,它在碱性介质中很不稳定,与空气接触即被氧化生成棕色的MnO(OH)2沉淀或MnO2·H2O。
MnSO4 +
2NaOH  Mn(OH)2↓+ Na2SO4 Mn(OH)2↓+ Na2SO4
2Mn(OH)2 +
O2  2MnO(OH)2 2MnO(OH)2
多数锰(Ⅱ)盐如卤化锰、硝酸锰、硫酸锰等强酸盐都易溶于水。在水溶液中,Mn2+离子常以淡红色的[Mn(H2O6)]2+水合离子存在。从溶液中结晶出的锰(Ⅱ)盐是带结晶水的粉红色晶体。例如,MnCl2·4H2O、Mn(NO3)2·6H2O和Mn(ClO4)2·6H2O等。
二氧化锰与浓H2SO4反应而得到硫酸锰MnSO4·xH2O(x=1,4,5,7)
2MnO2 +
2H2SO4 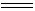 2MnSO4 + 2H2O + O2↑
2MnSO4 + 2H2O + O2↑
室温下,MnSO4·5H2O是较稳定的,加热脱水为白色无水硫酸锰,在红热时也不分解,所以硫酸锰是最稳定的锰(Ⅱ)盐。不溶性的锰盐有碳酸锰、磷酸锰、硫化锰等。

唯一重要的锰(Ⅳ)化合物是二氧化锰MnO2,它是一种很稳定的黑色粉末状物质,不溶于水。许多锰的化合物都是用MnO2作原料而制得的。
二氧化锰在酸性介质中是一种强氧化剂,而本身转化成Mn2+。例如,它与浓盐酸反应可得到氯气。
MnO2 + 4HCl
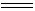 MnCl2 + Cl2↑+ 2H2O MnCl2 + Cl2↑+ 2H2O
实验室中常用此反应制备氯气。
二氧化锰在碱性介质中,有氧化剂存在时,还能被氧化而转变成锰(Ⅵ)的化合物。例如,MnO2和KOH的混合物于空气中,或者与KClO3、KNO3等氧化剂一起加热熔融,可以得到绿色的锰酸钾K2MnO4
2MnO2 + 4KOH + O2
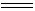 2K2MnO4 +
2H2O 2K2MnO4 +
2H2O
3MnO2 + 6KOH + KClO3
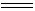 3K2MnO4 +
KCl + 3H2O 3K2MnO4 +
KCl + 3H2O

锰(Ⅵ)的化合物中,比较稳定的是锰酸盐,如锰酸钠和锰酸钾。锰酸盐是制备高锰酸盐的中间产品。锰酸盐只有在强碱性溶液中(pH>14.4)才是稳定的。如果在酸性甚至近中性的条件下,MnO42-易按下式发生歧化。
3MnO42- + 4H+
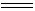 2MnO4- +
MnO2 + 2H2O 2MnO4- +
MnO2 + 2H2O

锰(Ⅶ)的化合物中最重要的是高锰酸钾。
高锰酸钾是深紫色的晶体,它是一种较稳定的化合物,其水溶液呈紫红色。将固体KMnO4加热到473K以上,就分解放出氧气,是实验室制备氧气的一种简便方法。
2KMnO4 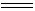 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
高锰酸钾的溶液并不十分稳定,在酸性溶液中缓慢地分解:
4MnO4- +
4H+ 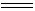 4MnO2 + 3O2 + 2H2O
4MnO2 + 3O2 + 2H2O
在中性或微碱性溶液中,这种分解速度更慢。但是光对高锰酸盐的分解起催化作用,因此,KMnO4溶液必须保存于棕色瓶中。
KMnO4是最重要和常用的氧化剂之一。它的还原产物因介质的酸碱性不同而有所不同。
在酸性溶液中MnO4-是很强的氧化剂。例如,它可以氧化Fe2+、I-、Cl-等离子,还原产物为Mn2+。
MnO4- + 5Fe2+ + 8H+
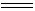 Mn2+
+ 5Fe3+ + 4H2O Mn2+
+ 5Fe3+ + 4H2O
分析化学中,用KMnO4的酸性溶液测定铁的含量,就是利用此反应。如果MnO4-过量,它可能和Mn2+发生氧化还原反应而析出MnO2。
2MnO4- + 3Mn2+ + 2H2O
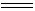 5MnO2 + 4H+ 5MnO2 + 4H+
MnO4-与还原剂的反应起初较慢,但Mn2+的存在,可以催化该反应。因此,随着Mn2+离子的生成,反应速度迅速加快。
在微酸性、中性或微碱性溶液中,MnO4-与还原剂反应时,被还原成MnO2。例如,在中性或弱碱性介质中,KMnO4与K2SO3的反应。
2KMnO4 + 3K2SO3 + H2O
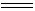 2MnO2↓+ 3K2SO4 + 2KOH 2MnO2↓+ 3K2SO4 + 2KOH
在强碱性溶液中,则被还原为锰酸盐。
2KMnO4 +
K2SO3 + 2KOH 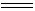 2K2MnO4 + K2SO4
+ H2O
2K2MnO4 + K2SO4
+ H2O

锰能生成以下各种氧化态的氧化物,见下表。
|
氧化数 |
+Ⅱ |
+Ⅲ |
+Ⅳ |
+Ⅵ |
+Ⅶ |
|
名
称 |
氧化锰 |
三氧化二锰 |
二氧化锰 |
锰酸酐 |
高锰酸酐 |
|
分子式 |
MnO |
Mn2O3 |
MnO2 |
(MnO3) |
Mn2O7 |
|
酸碱性 |
碱性 |
两性 |
弱酸性 |
酸性 |
酸性 |
|
氧化物水合物 |
Mn(OH)2 |
Mn(OH)3 |
Mn(OH)4 |
H2MnO4 |
HMnO4 |
|
变化规律 |
碱性增强, 还原性增强
←───────────────────
───────────────────→
酸性增强, 氧化性增强 |
锰的各种氧化物中以MnO2最为重要,因为它最稳定,是常用的氧化剂。
粉末状的KMnO4与90%H2SO4反应,生成绿色油状的高锰酸酐Mn2O7。它在273K以下稳定,在常温下会爆炸分解成MnO2、O2和O3。这种氧化物有强氧化性,遇有机物就发生燃烧。

|