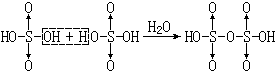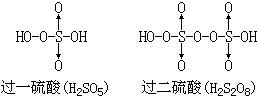|
硫原子的价电子层结构为:
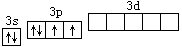
这一结构决定了硫原子在形成化合物时,可按多种成键方式进行,主要有下列几种:
(1)从电负性较小的原子中夺取2个电子形成含S2-离子的离子型化合物。
(2)与电负性较大的原子共用电子形成含两个共价单键的共价化合物。
(3)在形成共价单键的同时,硫原子上孤电子对占据的轨道和配位原子轨道,可以组成各种类型的离域π键如π34、π46等。
(4)利用3d空轨道接受氧原子上的孤电子对形成p-dπ反馈键。
(5)利用3d空轨道接受由成对电子拆开而来的成单电子,进而形成共价键。硫的氧化数可以是+Ⅳ、Ⅵ。
(6)形成多硫链-Sx-的特点是本族其它元素不能比拟的。单质硫由8个S原子组成的环状分子或由n个S原子组成的链状分子所构成。化合物H2Sx、H2SxO6等分子中也含有硫原子数目不等的多硫链。
由此可见,硫在形成化合物时的成键特点和价键结构是多种多样的,现归纳在下表中。
|
结构基础 |
键 型 |
结构图式 |
σ键数目 |
π键 |
孤电子对数 |
分子形状 |
实例 |
| 类型 |
数目 |
|
S |
离子键 |
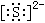
|
- |
- |
- |
- |
- |
Na2S,CaS |
|
共
价
键
|
成
键
轨
道 |
p |
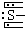
|
1 |
π34 |
2 |
1 |
直线 |
CS2 |
| sp2 |
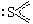
|
2 |
π34 |
1 |
1 |
角形 |
SO2 |
|
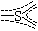
|
3 |
π46 |
1 |
0 |
平面三角形 |
SO3(g) |
|
sp3 |
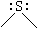
|
2 |
- |
0 |
2 |
角形 |
H2S,SCl2 |
|
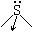
|
3 |
p-dπ |
1 |
1 |
三角锥 |
H2SO3 |
|
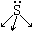
|
3 |
p-dπ |
3 |
1 |
三角锥 |
SO32- |
|
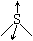
|
4 |
p-dπ |
2 |
0 |
四面体 |
H2SO4 |
|
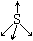
|
4 |
p-dπ |
4 |
0 |
正四面体 |
SO42- |
| sp2d |
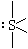 |
4 |
- |
0 |
1 |
变形四面体 |
SF4,SCl4 |
|
sp3d2 |
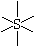
|
6 |
- |
0 |
0 |
八面体 |
SF6,S2F10 |
|
-Sx- |
x=2 |
S2Cl2,过硫化氢(H2S2)及其盐(Ns2S2,FeS2),连二硫酸(H2S2O6)等 |
|
x>2 |
多硫化氢(H2Sx)和多硫化物[Na2Sx,(NH4)2Sx],连多硫酸(H2S5O6)和连多硫酸盐(如Na2S4O6) |

一:物理性质
|
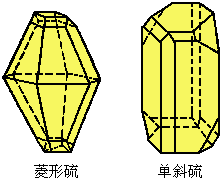
单质硫的同素异形体很多,据报导已接近50种,最常见的是斜方晶硫(也称菱形硫、a-硫,相对密度为2.06,熔点为385.8K)和单斜晶硫(也称β-硫,相对密度为1.99,熔点392K),如图12-14所示。这两种晶态硫在369K时发生转变。 |
|
|
图12-14 单质硫晶体 |
 |
 |
|
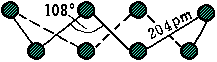
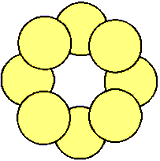
图12-15
S8环状结构(左为侧视图,右为俯视图)
|
根据分子量测定,斜方晶硫和单斜晶硫的分子都是由8个硫原子组成的环状结构,每个硫原子采取不等性sp3杂化并形成两个共价单键(图12-15)。
把单质硫加热到433K以上,S8环形分子破裂变成开链状的线形分子,并且聚合成更长链的大分子,粘度增高,颜色变暗红,约在503K将这种液态硫急速倾入冷水中,纠缠在一起的长链硫被固定下来,成为可以拉伸的弹性硫(Sμ)。经放置,无定形的弹性硫逐渐变成晶状硫。弹性硫与晶状硫不同点在于后者能完全溶于二硫化碳而前者仅部分溶解;若继续加热到563K以上,长硫链的大分子就断裂成短链的小分子,如S6、S3、S2等,粘度重新降低,流动性加大。到717.6K时,硫就变成了蒸气。根据蒸气密度测定,确知硫蒸气中含有S8、S6、S4和S2分子,其相对含量取决于温度的高低。当温度高于2000K时,还可以出现单原子分子硫。
二:化学性质
硫的化学性质比较活泼。它既能从电负性比它小的元素中取得2个电子形成S2-离子,又能共用2个电子形成氧化数为-Ⅱ的化合物,还能借助有效d轨道和电负性比它大的元素形成氧化数为+Ⅳ、+Ⅵ的化合物。因此单质硫既有氧化性又有还原性。
当硫和金属、氢、碳作用生成硫化物时,呈现出它的氧化性。如:
S + Fe  FeS
FeS
S + Hg  HgS
HgS
S + H2
 H2S H2S
2S + C  CS2
CS2
当硫和电负性比它大的非金属化合时,则表现出它的还原性。如:
S + 3F2
 SF6 SF6
S + O2
 SO2 SO2
S + 2Cl2
 SCl4 SCl4
2S + Cl2
 S2Cl2 S2Cl2
硫不仅能和单质作用,还能和碱或氧化性的酸起反应。如:
3S + 6NaOH  2Na2S
+ Na2SO3 + 3H2O
2Na2S
+ Na2SO3 + 3H2O
S + 6HNO3
 H2SO4 +
6NO2 + 2H2O H2SO4 +
6NO2 + 2H2O 实验室中可用碱来除去器皿中的硫污.

硫化氢是一种无色、具腐蛋臭味的气体,比空气略重。硫化氢分子是极性分子,但极性比水弱。由于分子间形成氢键的倾向很小,所以硫化氢的熔点(187K)和沸点(202K)都比水的低得多。硫化氢气能溶于水。在293K时,一体积水能溶解2.58体积的硫化氢气,浓度约为O.1mol/L。这个溶液叫氢硫酸。
干燥的硫化氢在室温下不与空气中的氧发生作用,但点燃时能在空气中燃烧,产生蓝色火焰,方程式如下:
2H2S +
3O2  2SO2 +
2H2O 2SO2 +
2H2O
2H2S +
O2  2S + 2H2O(氧不足时) 2S + 2H2O(氧不足时)
这说明硫化氢气在高温下有一定的还原性。
氢硫酸是二元弱酸,在水溶液中有如下电离:
H2S  H+ +
HS- K1=9.l×10-8
H+ +
HS- K1=9.l×10-8
HS-  H+ +
S2- K2=1.1×10-12
H+ +
S2- K2=1.1×10-12
氢硫酸比硫化氢气具有更强的还原性,常温下容易被空气中的氧氧化而析出单质硫,使溶液变浑。其标准电极电势如下:
S + 2H+
+ 2e  H2S
EAθ=O.14V H2S
EAθ=O.14V
可见,在酸性溶液中,它能使Fe3+、Br2、I2、MnO4-、CrO72-、HNO3等还原,本身一般被氧化成单质硫。但当氧化剂很强、用量又多时,也能被氧化到SO42-:
H2S +
I2  2HI + S 2HI + S
H2S +
4Br2 + 4H2O  H2SO4
+ 8HBr H2SO4
+ 8HBr

一:硫化物的概况 硫与电负性比它小的元素所形成的化合物称为硫化物。在硫化物中绝大多数是金属硫化物,而金属硫化物大多数是有颜色的、难溶于水的固体,只有碱金属的硫化物易溶,碱土金属硫化物,如CaS、SrS、BaS等微溶(见下表)。金属硫化物在水中有不同的溶解性和特征的颜色,这种特性在分析化学上用来鉴别和分离不同金属。
|
化学式 |
颜色 |
在水中 |
在酸中 |
溶度积 |
|
Na2S |
白色 |
易溶 |
易溶于稀酸中 |
- |
|
ZnS |
白色 |
不溶 |
易溶于稀酸中 |
1.2×10-23 |
|
MnS |
肉红色 |
不溶 |
易溶于稀酸中 |
1.4×10-15 |
|
FeS |
黑色 |
不溶 |
易溶于稀酸中 |
3.7×10-19 |
|
SnS |
褐色 |
不溶 |
稀酸中不溶,溶于浓盐酸 |
1.2×10-25 |
|
PbS |
黑色 |
不溶 |
稀酸中不溶,溶于浓盐酸 |
3.4×10-28 |
|
CdS |
黄色 |
不溶 |
稀酸中不溶,溶于浓盐酸 |
3.6×10-29 |
|
Sb2S3 |
桔红色 |
不溶 |
稀酸中不溶,溶于浓盐酸 |
2.9×10-59 |
|
Ag2S |
黑色 |
不溶 |
只溶于氧化性酸 |
1.6×10-49 |
|
CuS |
黑色 |
不溶 |
只溶于氧化性酸 |
8.5×10-45 |
|
HgS |
黑色 |
不溶 |
只溶于王水或浓Na2S溶液 |
4.0×10-53 |
由于氢硫酸是一个很弱的酸,这些硫化物无论是易溶或微溶于水都会产生一定程度的水解,而使溶液显碱性。如Na2S溶于水时几乎全部水解,其水溶液可作为强碱使用。Cr2S3、Al2S3在水中完全水解,因此,这些硫化物不能用湿法从溶液中制备。
Na2S
+ H2O  NaHS +
NaOH NaHS +
NaOH
2CaS + 2H2O
 Ca(OH)2
+ Ca(HS)2 Ca(OH)2
+ Ca(HS)2
Al2S3
+ 6H2O  2Al(OH)3↓
+ 3H2S↑ 2Al(OH)3↓
+ 3H2S↑ 二:硫化钠
硫化钠俗称臭碱,是一种白色晶体,熔点1453K,在空气中易潮解,Na2S·9H2O是常见的商品,它不仅易溶于水而且强烈水解,使溶液显碱性。因此工业上常以价格便宜的硫化钠代替氢氧化钠广泛地用于涂料、漂染、制革等工业中。工业上硫化钠是用煤粉或氢气在高温还原硫酸钠制得:
Na2SO4 +
4C  Na2S + 4CO Na2S + 4CO
Na2SO4 +
4H2  Na2S + 4H2O Na2S + 4H2O

可溶性的硫化物在溶液中能溶解单质硫生成多硫化物。如:
Na2S +
(x-l)S  Na2Sx Na2Sx
(NH4)2S +
(x-1)S  (NH4)2Sx (NH4)2Sx
多硫化物的颜色随着x(一般为2~6)的增加由浅黄直到红棕.实验室中长时间放置的硫化钠溶液成为黄色就是由于这一缘故.
多硫化物在酸性溶液中很不稳定,容易生成H2S和S:
Sx2-
+ 2H+  H2S
+ (x-1)S↓ H2S
+ (x-1)S↓
多硫化物是氧化剂。如(NH4)2S2能把SnS氧化:
SnS + (NH4)2S2
 (NH4)2SnS3 (NH4)2SnS3
这里Sn(Ⅱ)转化为Sn(Ⅳ),认为是在(NH4)2S2中的活性S作用下实现的
[(NH4)2S2  (NH4)2S + (S).(S)具有氧化性].
(NH4)2S + (S).(S)具有氧化性].

一:二氧化硫
二氧化硫是无色有刺激性臭味的气体,比空气重。它易溶于水,在293K时一体积水能溶解40体积SO2,相当于1.8mol/L或10%的溶液。它的熔点197K,沸点263K,易液化。液态二氧化硫蒸发时吸收大量的热,是一种致冷剂。它还是一种良好的非水溶剂。
二氧化硫有毒,吸入较多时会使嗓子变哑,喉头水肿,强烈刺激气管。空气中含量不得超过0.015mg/L。二氧化硫是大气污染物中危害较大的一种,主要来源于石油和煤中含硫物的燃烧。近年来对此已有重视。例如将烟道气中的SO2还原为单质硫,用碱液吸收SO2等已取得一定成绩。
在SO2中,S的氧化数为+Ⅳ,所以SO2既可表现还原性,又具氧化性。但还原性是主要的。只有遇到强还原剂时,它才表现氧化性。上面提到的从烟道气中回收硫就是利用这一性质。
SO2 +
2CO  S + 2CO2 S + 2CO2
二氧化硫还能和某些有机色素结合成为无色加合物而被用于漂白。然而这些无色加合物不稳定,时间一长有色物质又将复原。二氧化硫主要用于制造硫酸和合成洗涤剂。也用作消毒杀菌剂。
二:亚硫酸
二氧化硫的水溶液称为亚硫酸,它是二元中强酸,至今未制得游离的亚硫酸,它仅存于水溶液中,且存在下列平衡:
SO2 + H2O
 H2SO3 H2SO3
H2SO3
 H+ +
HSO3- K1=1.54×10-2 H+ +
HSO3- K1=1.54×10-2
HSO3-
 H+ +
SO32- K2=1.02×10-7 H+ +
SO32- K2=1.02×10-7
加热可使SO2逸出,加碱可以得到酸式盐或正盐。
同样,亚硫酸既具有还原性,又具有氧化性,但还原性是主要的. 三:亚硫酸盐
亚硫酸及其盐也象二氧化硫那样,既可作还原剂又可作氧化剂。由它们的标准电极电势可知,无论是酸还是盐,它们的还原性总大于它们的氧化性.
还原性: SO32->H2SO3>SO2
氧化性: SO2>H2SO3>SO32-
亚硫酸盐作为还原剂能和许多氧化剂如过氧化氢、高锰酸钾、重铬酸钾、卤素等发生反应.亚硫酸盐只有遇到强还原制,象锌粉、硫化氢等才表现出氧化性。
碱金属的亚硫酸盐易溶于水,由于水解,溶液显碱性,其它金属的正盐均微溶于水,而所有的酸式亚硫酸盐都易溶于水。亚硫酸盐受热容易分解。例如,亚硫酸钠在加热时,分解生成硫化钠和硫酸钠。
4Na2SO3
 3Na2SO4 +
Na2S 3Na2SO4 +
Na2S
亚硫酸盐或酸式亚硫酸盐遇强酸即分解,放出SO2。
SO32-
+ 2H+  H2O
+ SO2 H2O
+ SO2
HSO3-
+ H+  H2O + SO2 H2O + SO2
这是实验室制取少量SO2的一种方法。

一:三氧化硫 在室温下三氧化硫是一种无色的易挥发固体,熔点289.8K、沸点317K。它是一个强氧化剂,特别在高温时它能氧化磷、碘化钾和铁、锌等金属:
5S03 +
2P  5SO2 +
P2O5 5SO2 +
P2O5
2KI + SO3
 K2SO3
+ I2 K2SO3
+ I2
三氧化硫极易吸收水分,在空气中强烈冒烟,溶于水中即生成硫酸并放出大量热。这大量热使水蒸发,所产生的水蒸气与SO3形成酸雾,影响吸收的效果,所以工业上生产硫酸不是用水去吸收S03,而是用浓硫酸吸收SO3。将SO3溶解在浓硫酸中所生成的溶液称为发烟硫酸。当它暴露于空气中时,挥发出来的SO3和空气中的水蒸气形成硫酸的细小露滴而冒烟,所以称为发烟硫酸。通常以游离SO3的含量来标明不同浓度的发烟硫酸,如20%、40%等发烟硫酸即表示在100%硫酸中含有20%或40%游离的SO3。
二:硫酸 纯硫酸是无色的油状液体,283.4K时凝固,在液态和固态的硫酸分子间都存在着氢键。作为溶剂,硫酸的介电常数很高(293K时为110)能很好溶解离子型化合物,100%H2SO4具有相当高的电导率是由于它的自偶电离生成以下两种离子:
2H2SO4
 H3SO4+
+ HSO4- K=2.7×10-4 H3SO4+
+ HSO4- K=2.7×10-4
加热硫酸时,它会放出SO3直至酸的浓度降低到98.3%为止,这时它成为恒沸溶液,沸点为611K.硫酸溶液是强的二元酸,第一步电离是完全的,K2=1.2×10-2
浓硫酸溶于水形成一系列很稳定的水合物H2SO4·nH2O(n=1-5),故浓硫酸有强烈的吸水性,其水合过程放出大量的热.常用它来作干燥剂.它不但能吸收游离的水分,还能从一些有机化合物中夺取与水分子组成相当的氢和氧,使这些有机物炭化。例如,蔗糖或纤维被浓硫酸脱水:
C12H22O11
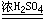 12C +
11H2O 12C +
11H2O
因此,浓硫酸是一个强脱水剂,能严重地破坏动植物的组织,如损坏衣服和烧坏皮肤等,使用时必须注意安全。
浓硫酸是一种氧化性酸。加热时氧化性更显著,它可以氧化许多非金属和金属。但金和铂甚至在加热时也不与浓硫酸作用。此外冷浓硫酸(93%以上)不和铁、铝等金属作用,因为铁、铝在冷浓硫酸中被钝化了,故可将浓硫酸装在钢罐中运输。稀硫酸具有一般酸类的通性,与浓H2SO4的氧化反应不同,稀硫酸的氧化反应是由H2SO4中的H+离子所引起的。只能与电位顺序在H以前的金属如Zn、Mg、Fe等反应而放出H2。
三:硫酸盐 硫酸能形成酸式盐和正盐两种类型的盐。在酸式硫酸盐中,仅最活泼的碱金属元素(Na、K)能形成稳定的固态酸式硫酸盐。在碱金属的硫酸盐溶液内加入过量的硫酸便有酸式硫酸盐生成。
Na2SO4 +
H2SO4  2NaHSO4 2NaHSO4
酸式硫酸盐均易溶于水,也易熔化。加热到熔点以上,它们即转变为焦硫酸盐M2S2O7,再加强热,就进一步分解为正盐和三氧化硫。 硫酸盐的热稳定性与相应阳离子的电荷、半径以及最外层的电子构型有关。如K2SO4、Na2SO4、BaSO4等硫酸盐较稳定,在1273K时也不分解。这是由于这些盐的阳离子是低电荷和8电子构型,它们即使在高温下对稳定的SO42-离子极化作用也很小。而CuSO4、Ag2SO4、Al2(SO4)3、Fe2(SO4)3、PbSO4等硫酸盐,它们的阳离子多是高电荷和18电子构型或不规则构型。离子极化作用较强,在高温下,晶格中离子的热振动加强,强化了离子之间的相互极化,阳离子起着向硫酸根离子争夺氧的作用。因而,在高温下这些金属盐一般先分解成金属氧化物和SO3如:
CuSO4  CuO +
SO3
CuO +
SO3
Ag2SO4
 Ag2O +
SO3 Ag2O +
SO3
Ag2O
 2Ag +
1/2O2 2Ag +
1/2O2
一般硫酸盐都易溶于水。硫酸银略溶,碱土金属(Be、Mg除外)和铅的硫酸盐微溶。可溶性硫酸盐从溶液中析出的晶体常带有结晶水如CuSO4·5H2O、FeSO4·7H2O、Na2SO4·10H2O等。除了碱金属和碱土金属外,其它硫酸盐都有不同程度的水解作用。
多数硫酸盐有形成复盐的趋势,在复盐中的两种硫酸盐是同晶型的化合物,这类复盐又叫做矾。常见的复盐有两类:一类的组成通式是MI2SO4·MIISO4·6H2O,其中
MI=NH4+、K+、Rb+、Cs+,MII=Fe2+、Co2+、Ni2+、Zn2+、Cu2+、Mg2+。属于这一类的复盐,如摩尔盐(NH4)2SO4·FeSO4·6H2O,镁钾矾K2SO4·MgSO4·6H2O。另一类组成的通式是MI2SO4·MⅢ2(SO4)3·24H2O,共中MI=碱金属(Li除外)、NH4+、Tl+.
MⅢ=Al3+、Fe3+、Cr3+、Ga3+、V3+、Co3+。属于这一类的复盐,如明矾K2S04·Al2(S04)3·24H2O。它们通式的简式可写为MIMⅢ(SO4)2·12H2O。

硫代硫酸钠(Na2S2O3·5H2O)又称海波或大苏打。硫代硫酸钠是无色透明的结晶,易溶于水,其水溶液显弱碱性。硫代硫酸钠在中性、碱性溶液中很稳定,在酸性溶液中迅速分解。
Na2S2O3 +
2HCl  2NaCl + S↓ +
SO2↑ + H2O 2NaCl + S↓ +
SO2↑ + H2O
硫代硫酸钠是一种中等强度的还原剂,与碘反应时,它被氧化为连四硫酸钠;与氯、溴等反应时被氧化为硫酸盐。因此,硫代硫酸钠可做为脱氯剂。
2Na2S2O3
+ I2  Na2S4O6 + 2NaI Na2S4O6 + 2NaI
Na2S2O3 +
4Cl2 + 5H2O  2H2SO4 + 2NaCl + 6HCl 2H2SO4 + 2NaCl + 6HCl 硫代硫酸根有很强的配位能力
2S2O32- +
Ag+  [Ag(S2O3)2]3- [Ag(S2O3)2]3-
照相底片上未曝光的溴化银在定影液中即由于形成这个配离子而溶解。

连二亚硫酸钠又称保险粉。在空气中极易被氧化,不便于使用,经酒精和浓NaOH共热后,就成为比较稳定的无水盐。
Na2S2O4是一种白色固体,加热至402K即分解:
2Na2S2O4
 Na2S2O3 +
Na2SO3 + SO2 Na2S2O3 +
Na2SO3 + SO2
从硫的电势图可见,Na2S2O4是一个很强的还原剂,它的水溶液在空气中放置能被空气中的氧氧化,生成亚硫酸盐或硫酸盐,因此,Na2S2O4在气体分析中用来吸收氧气:
2Na2S2O4 + O2 + 2H2O  4NaHSO3
4NaHSO3
Na2S2O4
+ O2 + H2O  NaHSO3
+ NaHSO4 NaHSO3
+ NaHSO4
Na2S2O4是印染工业中非常重要的还原剂,有许多有机染料都能被它还原,它还用于染料合成、造纸、保存食物和医学等部门。

焦硫酸是一种无色的晶状固体、熔点308K。当冷却发烟硫酸时,
可以析出焦硫酸晶体。
焦硫酸可看作是由两分子硫酸脱去一分子水所得的产物:
焦硫酸与水反应又生成H2SO4。焦硫酸具有比浓硫酸更强的氧化性,吸水性和腐蚀性,在制造某些染料、炸药中用作脱水剂。
将碱金属的酸式硫酸盐加热到熔点以上,可得焦硫酸盐。
2KHSO4  K2S2O7 +
H2O
K2S2O7 +
H2O
进一步加热,分解为K2SO4和SO3
K2S2O7
 K2SO4 +
SO3 K2SO4 +
SO3
焦硫酸盐在无机合成上的一个重要用途是与一些难熔的碱性金属氧化物(如Fe2O3,Al2O3,TiO2等)共熔生成可溶性的硫酸盐。
Fe2O3 +
3K2S2O7  Fe2(SO4)3 +
3K2SO4
Fe2(SO4)3 +
3K2SO4
Al2O3 +
3K2S2O7  Al2(SO4)3 +
3K2SO4
Al2(SO4)3 +
3K2SO4

过硫酸可以看成是过氧化氢中氢原子被HSO3-取代的产物。HO·OH中一个H被HSO3-取代后得HO·OSO3H,即过一硫酸;另一个H也被HSO3-取代后,得HSO3O0·0SO3H,即过二硫酸,它的结构式见表12-4。
过二硫酸是无色晶体,在338K时熔化并分解,具有极强的氧化性,它不仅能使纸炭化,还能烧焦石蜡。
所有的过硫酸盐都是强氧化剂。例如,过硫酸钾和铜能按下式反应:
Cu + K2S2O8
 CuSO4 +
K2SO4 CuSO4 +
K2SO4
过硫酸盐在Ag+离子的作用下,能将Mn2+氧化成MnO4-离子:
2Mn2+ +
5S2O82- + 8H2O 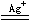 2Mn04- +
10S042- + 16H+
2Mn04- +
10S042- + 16H+
在钢铁分析中常用过硫酸铵(或过硫酸钾)氧化法测定钢中锰的含量。
应该指出,过二硫酸及其盐作为氧化剂在氧化还原反应过程,它的过氧链断裂,其中两个氧原子的氧化数从-Ⅰ降到-Ⅱ,而硫的氧化数不变仍然是+Ⅵ。
过硫酸及其盐都是不稳定的,在加热时容易分解,例如,K2S2O8受热时会放出SO3和O2:
2K2S2O8
 2K2SO4 +
2SO3 + O2 2K2SO4 +
2SO3 + O2

连多硫酸的通式为H2SxO6,x=3~6。其盐的阴离子通式为[O3SSySO3]2-,y=l~4的连多硫酸盐已经肯定。根据分子中硫原子的总数,可把它们命名为连三硫酸S3O62-、连四硫酸S4O62-等。
连二硫酸与连多硫酸的最根本差别是前者酸根中仅有一个[O3S—SO3]2-结构,而后者的酸根中至少含有一个或一个以上的仅仅和其它硫原子相连的硫原子([O3S-S-SO3]2-). 连多硫酸根中都有硫链。游离的连多硫酸不稳定,迅速分解。连多硫酸的酸式盐不存在。
H2S5O6
 H2SO4
+ SO2 + 3S H2SO4
+ SO2 + 3S 连二硫酸不易被氧化,而其它连多硫酸则容易被气化,如在室温时,氯与连二硫酸不作用,而能把连多硫酸氧化为硫酸:
H2S3O6 +
4Cl2 + 6H2O  3H2SO4 + 8HCl
3H2SO4 + 8HCl
连二硫酸不与硫结合产生较高的连多硫酸,其它连多硫酸则可以:
H2S4O6 +
S  H2S5O6 H2S5O6
连二硫酸是一种强酸,它较连多硫酸稳定,浓溶液或加热时才慢慢分解:
H2S2O6
 H2SO4 +
SO2 H2SO4 +
SO2
连二硫酸的水溶液即使煮沸也不分解。

一:二氯化二硫(S2Cl2)
将干燥氯气通入熔融硫可制得S2Cl2,它是一种橙黄色有恶臭的液体,通水很容易水解:
2S2Cl2 + 2H2O  4HCl
+ SO2 + 3S
4HCl
+ SO2 + 3S
在橡胶硫化时,S2Cl2是硫的溶剂。
二:六氯化硫(SF6)
硫与氟激烈反应生成SF6。它是无色、无臭的气体,它的特点是极不活泼,不与水、酸反应,甚至与熔融的碱也不反应。但它与水反应的自由能变化的负值却很大:
SF6(g) +
3H2O(g)  SO3(g) + 6HF(g)
△Gθ=-460 kJ·mol-1 SO3(g) + 6HF(g)
△Gθ=-460 kJ·mol-1
SF6的不活泼性可能是S—F键的强度较大,SF6分子的对称性强和中心硫原子的配位数达到饱和等因素综合的结果,显然也有动力学的因素
SF6的主要用途是在高压发电机或其它高压电器设备中作为绝缘气体。
三:卤磺酸
含氧酸中的羟基被卤素取代后的衍生物叫做酰卤化物或卤化酰。例如,硫酸中的羟基被卤素取代得到卤化硫酰如SO2F2、SO2Cl2、SO2FCl等。如果H2SO4中仅有一个羟基被卤素取代即得到卤磺酸,如氟磷酸HSO3F、氯磺酸HSO3Cl等。
氟磺酸是一种很重要的强酸性溶剂。当SbF6(它是一种较强的路易斯酸)与HSO3F反应后,其产物是一种更强的酸称为超强酸或超酸;
SbF5 + HSO3F →
H[SbF5(OSO2F)]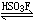 H2SO3F+
+ [SbF5(OSO2F)]- H2SO3F+
+ [SbF5(OSO2F)]-
超酸大多由强质子酸和强路易酸混合而成。吉莱斯宾(Gillespine
R.J.)对超酸所下的定义是:比100%H2SO4更强的酸称为超强酸。衡量超强酸的强弱是看它与特定碱反应时,给予质子能力的大小。HSO3F-SbF5是一种典型的超强酸,当两者的摩尔比为1:1时,它比100%H2SO4强一千亿倍,它是一种极强的质子化作用试剂。高氯酸比1005H2SO4强10倍属于超强酸,硝酸就不是超强酸。
超强酸的重要用途是它能向链烷烃供给质子,使其质子化产生碳正离子:
R3CH + H2SO3F+ R3CH2+ +
HSO3F R3CH2+ +
HSO3F H2 +
R3C+ + HSO3F H2 +
R3C+ + HSO3F 而碳正离子是有机化学的一个新发展。另外超强酸对链状卤素和硫阳离子的研究提供了一个优良的溶剂介质。由于链状卤素和硫阳离子有非常强的氧化性和酸性,因此,严格要求溶剂介质是无还原性和不显碱性的,超强酸则符合这种要求。

|