|
一:过渡元素的组成
周期表中ⅢB族至Ⅷ族(不包括镧以外的镧系元素和锕以外的锕系元素)称为过渡元素,过渡元素即d区元素,它们的(n-1)d轨道均未填满,如下表所示。虽ⅠB、ⅡB族元素的(n-1)d轨道均已填满,但这两族元素的性质在许多方面与过渡元素相似,因之也有人主张将它们包括在过渡元素的范围内。本课程系采取前一观点来讨论本章内容。
|
ⅢB
|
ⅣB
|
ⅤB
|
ⅥB
|
ⅦB
|
ⅧB
|
ⅠB
|
ⅡB
|
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
Co Ni
|
Cu
|
Zn
|
|
Y
|
Zr
|
Nb
|
Mo
|
Tc
|
Ru
Rh Pd
|
Ag
|
Cd
|
|
La
|
Hf
|
Ta
|
W
|
Re
|
Os
Ir Pt
|
Au
|
Hg |
|
Ac
|
- |
- |
- |
- |
- |
- |
- |
同一周期的过渡元素有许多相似性,如金属性递变不明显,原子半径、电离势等随原子序数增加,虽有变化但不显著,都反映出各元素间从左到右的水平相似性,所以也可将这些过渡元素按周期分为三个系列。即位于周期表中第4周期的Sc-Ni称第一过渡系元素;第5周期中的Y-Pd为第二过渡系元素;第6周期中的La-Pt为第三过渡系元素。
二:过渡元素的共性
过渡元素有许多共同的性质:
(1)它们都是金属。它们的硬度较大,熔点和沸点较高,导热、导电性能好,延展性好。它们相互之间或与其它金属元素易生成合金。
(2)大部分过渡金属的电极电势为负值,即还原能力较强。例如第一过渡系元素一般都能从非氧化性酸中置换出氢。
(3)除少数例外,它们都存在多种氧化态。它们的水合离子和酸根离子常呈现一定的颜色。
(4)由于具有部分填充的电子层,它们能形成一些顺磁性化合物。
(5)它们的原子或离子形成配合物的倾向都较大。
以上这些性质都和它们的电子构型有关。

过渡元素的原子电子构型的特点是它们都具有未充满的d轨道(Pd例外),最外层也仅有1-2个电子,因而它们原子的最外两个电子层都是未充满的,所以过渡元素通常是指价电子构型为(n-1)d1-9ns1-2
的元素。下表为过渡金属的价电子构型。
|
元素
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
|
价电子构型
|
3d14s2
|
3d24s2
|
3d34s2
|
3d54s1
|
3d54s2
|
3d64s2
|
3d74s2
|
3d84s2
|
|
元素
|
Y
|
Zr
|
Nb
|
Mo
|
Tc
|
Ru
|
Rh
|
Pd
|
|
价电子构型
|
4d15s2
|
4d25s2
|
4d45s1
|
4d55s1
|
4d65s1
|
4d75s1
|
4d85s1
|
4d105s0
|
|
元素
|
La
|
Hf
|
Ta
|
W
|
Re
|
Os
|
Ir
|
Pt
|
|
价电子构型
|
5d16s2
|
5d26s2
|
5d36s2
|
5d46s2
|
5d56s2
|
5d66s2
|
5d76s2
|
5d96s1
|
对于过渡金属元素,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子也可以部分或全部参加成键。

因为过渡元素除最外层的s电子可以作为价电子参与成键外,次外层d电子也可部分或全部作为价电子参加成键,所以过渡元素常有多种氧化态。一般可由+Ⅱ依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的表现以第一过渡系最为典型。
第一过渡系元素的氧化态
|
元素
|
Se
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
|
氧
化
态
|
+Ⅲ
|
+Ⅱ
+Ⅲ
+Ⅳ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
|
+Ⅱ
+Ⅲ
+Ⅵ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅵ
+Ⅶ
|
+Ⅱ
+Ⅲ
+Ⅵ
|
+Ⅱ
+Ⅲ
+Ⅳ
|
+Ⅱ
+Ⅲ
+Ⅳ
|
(下划线的表示常见的氧化态)
由上表可看出随着原子序数的增加,氧化态先是逐渐升高,后又逐渐降低。这种变化主要是由于开始时3d轨道中价电子数增加,氧化态逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。因此高氧化态逐渐不稳定(呈现强氧化性),随后氧化态又逐渐降低。
第二、三过渡系元素氧化态的情况见下表所示。
|
元
素
|
Y
|
Zr
|
Nb
|
Mo
|
Tc
|
Ru
|
Rh
|
Pd
|
|
氧
化
态
|
+Ⅲ
|
+Ⅱ
+Ⅲ
+Ⅳ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
+Ⅶ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
+Ⅶ
+Ⅷ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
|
+Ⅱ
+Ⅲ
+Ⅳ
|
|
元
素
|
La
|
Hf
|
Ta
|
W
|
Re
|
Os
|
Ir
|
Pt
|
|
氧
化
态
|
+Ⅲ
|
+Ⅲ
+Ⅳ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
|
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
+Ⅶ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
+Ⅷ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
|
+Ⅱ
+Ⅲ
+Ⅳ
+Ⅴ
+Ⅵ
|
这两个过渡系元素的氧化态从左到右的变化趋势与第一过渡系元素是一致的。不同的只是在于这两列元素的最高氧化态呈现稳定态势,而低氧化态化合物并不常见。
综上所述,过渡元素的氧化态表现有一定的规律性,即同一周期从左到右,氧化态首先逐渐升高,随后有逐渐降低。同一族中从上到下高氧化态趋向于比较稳定。这和主族元素不同。因为主族元素价电子层的ns电子从上到下表现为惰性电子对而不易参加成键的趋势增强,所以主族元素的氧化态表现为从上到下低氧化态趋于稳定。

过渡元素与同周期的ⅠA、ⅡA族元素相比较,原子半径较小。过渡元素的原子半径随着原子序数变化的情况参看图14-1和下表。
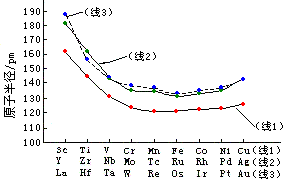 |
| 图14-1
过渡元素的原子半径 |
第一过渡系元素的某些性质*
|
元
素
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
Cu
|
|
原子序数
|
21
|
22
|
23
|
24
|
25
|
26
|
27
|
28
|
29
|
|
金属半径/pm
|
160.6
|
144.8
|
132.1
|
124.9
|
124
|
124.1
|
125.3
|
124.6
|
127.8
|
|
M2+半径/pm
|
|
94
|
88
|
89
|
80
|
74
|
72
|
69
|
72
|
|
密度/(g.cm-3)
|
2.989
|
4.54
|
6.11
|
7.20
|
7.44
|
7.874
|
8.90
|
8.902
|
8.96
|
*为了便于比较,将Cu的有关数据也列于表中。
由图可见,各周期中随原子序数的增加,原子半径依次减少,但变化得很缓慢。各族中从上到下原子半径增大,但第5、6周期同族元素的原子半径很接近(而鉿的原子半径比锆还小)。上述情况是由于过渡元素d轨道的电子未充满,d电子的屏蔽效应较小,而核电荷却依次增加,对外层电子云的吸引力增大,所以原子半径依次减小,直到铜副族前后,d轨道充满使屏蔽效应增强,才使原子半径又出现增大。至于第5、6周期同族元素原子半径的相近,则是由于镧系收缩的影响而引起的。
过渡元素的离子半径变化规律和原子半径变化相似。即同一周期中氧化态相同的离子半径自左向右随核电荷的增加而逐渐变小。同族元素的最高氧化态的离子半径自上向下随电子层增加而增加。同样由于镧系收缩的缘故,第5、6周期同族元素的离子半径很相近。
ⅢB-ⅦB族元素最高氧化态的离子半径
|
离子半径/pm
|
Sc3+
73.2
|
Ti4+
68
|
V5+
59
|
Cr6+
52
|
Mn7+
46
|
|
离子半径/pm
|
Y3+
89.3
|
Zr4+
79
|
Nb5+
69
|
Mo6+
62
|
Tc7+
-
|
|
离子半径/pm
|
La3+
101.6
|
Hf4+
78
|
Ta5+
68
|
W6+
62
|
Re7+
56
|

一、物理性质
由于过渡元素的最外层s电子和次外层d电子都可以参加成键,从而增加了金属键的强度,又因它们具有较小的原子半径,因此过渡金属单质具有高熔点,高沸点,高密度及高硬度等特点。例如第三过渡系元素几乎都具有特别大的密度,锇、铱、铂的密度分别为22.57,22.42和21.45g.cm-3。钨的熔点为3683K,是所有金属中最难熔的。
另外,许多过渡金属及其化合物有顺磁性,这也是因为它们具有未成对d电子所引起的。过渡元素的纯金属有较好的延展性和机械加工性,并且能彼此间以及与非过渡金属组成具有多种特征的合金。过渡金属都是电和热的较良导体,它们在工程材料方面有着广泛的应用。
二、化学性质
钪、钇和镧是过渡元素中最活泼的金属,它们在空气中能迅速被氧化,与水反应则放出氢,也能溶于酸,这是因为它们的次外层d轨道中仅有一个电子,这个电子对它们性质的影响不显著,所以它们的性质较活泼并接近于碱土金属。其它过渡金属在通常情况下不与水作用。从它们的标准电极电势(见下表)看,过渡元素一般都可以从稀酸(盐酸和硫酸)中置换氢。
第一过渡系元素的标准电极电势
|
金属电极电势
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
|
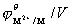
|
-
|
-1.63
|
-1.18
|
-0.91
|
-1.19
|
-0.473
|
-0.277
|
-0.232
|
|
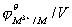
|
-2.0
|
-
|
-
|
-0.74
|
-
|
-
|
-
|
-
|
上表数据表明,过渡金属的标准电极电势基本上从左到右数值逐渐增大,这和它们的金属性逐渐减弱是一致的。其中锰的数值比铬还低,显得有些例外,但这和锰失去两个4s电子后形成更稳定的3d5构型有关。
与第一过渡系元素相比(ⅢB族除外),第二、三过渡系元素的活泼性都较弱。即同一族中自上而下,活泼性依次减弱,这与ⅠA族、ⅡA族不同。这可从它们的核电荷和原子半径来考虑,而核电荷因素在这里起着主导作用。因为同一族中自上而下原子半径增加不大,而核电荷却增加较多,对外层电子的吸引力增强,特别是第三过渡系元素,它们与相应的第二过渡系元素相比原子半径增加很少(镧系收缩的影响),所以其化学性质显得更不活泼。

过渡元素氧化物(氢氧化物或水合氧化物)的碱性,同一周期中从左到右逐渐减弱。例如Sc2O3为碱性氧化物,TiO2为具有两性的氧化物,CrO3是较强的酸酐(铬酸酐),而Mn2O7在水溶液中已成强酸了。Fe,Co和Ni不能生成稳定的高氧化态的氧化物。在同一族中各元素自上而下,氧化态相同时酸性减弱,而碱性逐渐增强。如Ti、Zr、Hf的氢氧化物M(OH)4(或H2MO3)中,Ti(OH)4的碱性比较差一些。这种有规律的变化是和过渡元素高氧化态离子半径有规律的变化相一致的。
此外,同一元素在高氧化态时酸性较强,随着氧化态的降低而酸性减弱(或碱性增强)。例如,不同氧化态锰的氧化物的酸碱性变化,如下表所示。
|
锰的氧化态
|
+Ⅱ
|
+Ⅲ
|
+Ⅳ
|
+Ⅵ
|
+Ⅶ
|
|
氧 化 物
|
MnO
|
Mn2O3
|
MnO2
|
MnO3
|
Mn2O7
|
|
酸 碱 性
|
碱性
|
弱碱性
|
两性
|
酸性
|
酸性
|

过渡元素的离子在水溶液中常显出一定的颜色,这也是过渡元素区别于s区金属离子(Na+,Ca2+等)的一个重要特征,如下表所示。
关于离子有颜色的原因是很复杂的。过渡元素的水合离子之所以具有颜色,是与它们的离子存在未成对的d电子有关。
|
水合离子
|
Ti2+
|
V2+
|
V3+
|
Cr3+
|
Mn2+
|
Fe2+
|
Fe3+
|
Co2+
|
Ni2+
|
|
颜色
|
紫红
|
紫
|
绿
|
蓝紫
|
肉色
|
浅绿
|
淡紫
|
粉红
|
绿
|

前已指出,过渡元素的原子或离子具有(n-1)d,ns和np共9个价电子轨道。对过渡金属离子(或原子)而言,它们的ns和np轨道是空的,(n-1)d轨道为部分空或者全空,这种电子构型都具有接受配位体孤电子对的条件。因此它们的原子和离子都有很强的形成配合物的倾向。例如,过渡元素一般都容易形成氟配合物、氰配合物、草酸根配合物等,这些内容将在以后各节中分别介绍。
从以上讨论可知,过渡元素在性质上区别于其它类型元素,是和它们具有不全满的d电子有关,这是过渡元素的特点,也是学习过渡元素化学时应充分注意的。

|
