
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、碳、硅同为第ⅤA族元素且在周期表中位置相 邻,为什么CO2为气态,而SiO2则为坚硬的固态?
碳元素与硅元素的原子结构相似,故其单质及化合物在物理、化学性质方面有很多相似之处。比如,其单质均可形成微观四面体结构(金刚石与晶体硅);其简单氢化物分子均为正四面体型结构;最高价氧化物的水化物均为弱酸等。
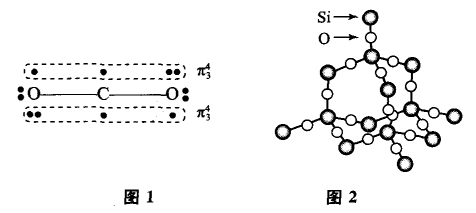
但是应该注意到,碳与硅在原子结构方面也有不同点。比如,它们的原子半径不同、碳原子最外层不存在d轨道而硅原子最外层有3d轨道等。这些结构差异导致了2种元素的单质及某些化合物性质上的差异。比如,碳的单质除金刚石外,还有层状结构的石墨——同一层内碳原子间彼此结合形成一个个平面正六边形,这是由于碳的原子半径不大,平面内相邻原子间距离小的缘故,故各碳原子未杂化的2p轨道可以彼此重叠,形成“超大规模的离域π键"(这些离域电子使得石墨具有很强的导电性);而硅则因为原 子半径大,即使形成平面结构,也会由于相邻原子间距离过大,彼此间的3p轨道难以重叠形成稳定的离域π键,所以硅的单质很难形成类似于石墨的层状晶体结构。
CO2常温下呈气态,是因为CO2形成的是小分子结构,碳原子首先以sp杂化轨道与氧原子形成σ键,碳、氧原子未杂化的p轨道间还可以从侧面发生 电子云重叠形成稳定的π键,这样构成了稳定的CO2 小分子,如图1所示,CO2分子间作用力弱,所以常温下呈气态。而在硅的氧化物中,由于硅原子半径太大, 硅原子与氧原子间距离相对较远,硅原子的P轨道很难与氧原子的p轨道发生有效重叠形成稳定的σ键, 故Si原子只好发生sp3杂化,用4个杂化轨道分别通过。键结合氧原子(而每个氧原子则结合2个硅原 子),形成微观正四面体结构,如图2所示,这种结构向空间伸展开来,构成了空间网状结构的原子晶体,形成熔、沸点非常高的晶体。
可以设想,在很高的温度下,也可能存在类似于CO2的小分子状态的SiO2,还可以设想,CO2能不能形成类似于SiO2的具有微观四面体结构的原子晶体呢?如果制得了原子晶体的 CO2,其性质将是怎样的呢?这个问题科学家早就想到了,而且不断有人尝试运用高压条件合成具有空间网状结构的原子晶体CO2。如果制得这样的晶体,它 的硬度将比SiO2(石英晶体)高很多,因为碳的原子半 径比硅小得多,C一O键的键能比Si—O键要大得多。
2、 CO2与SiO2的化学性质有何相似与不同?
CO2与SiO2同属碳族元素的最高价氧化物,因 此具有十分相似的化学性质.
1)二者同属酸酐,均可以跟碱反应生成含氧酸盐。
如:CO2+2OH-=CO32-+H2O, SiO2+2OH-=SiO32-+H2O。
2)二者均具有一定的氧化性。
如:CO2+C 2CO,
2CO,
SiO2+2C Si+2CO↑ ,
Si+2CO↑ ,
CO2+2Mg  C+2MgO,
C+2MgO,
SiO2+2Mg Si+2MgO。
Si+2MgO。
当然,二者也有些不同,比如CO2在水中有一定的溶解度,它可以与水直接化合形成H2CO3(CO2+H2O=H2CO3),而SiO2由于很难溶解,故一般不认为它可以与H2O直接化合,要由SiO2制取H2SiO3 的话,一般釆取如下2步反应:
SiO2+2OH-=SiO32- +H2O,
SiO32-+ H2O+CO2= H2SiO3↓+CO32-
3、如何理解 Na2SiO3+CO2+H2O = H2SiO3↓+Na2CO3 与 SiO2+Na2CO3 Na2SiO3+CO2↑ 2 个反应?
Na2SiO3+CO2↑ 2 个反应?
Na2SiO3+CO2+H2O = H2SiO3↓+Na2CO3, 该反应显然是遵循“强酸制弱酸”原理的(当然,这里 还附加了1个硅酸形成沉淀的动力机制),根据元素周期律,碳元素的非金属性比硅元素强,它的最高价氧化物水化物(H2CO3)的酸性比硅的最高价氧化物水化物的酸性强,故碳酸可以把硅酸从其盐溶液中 “置换"出来。
而反应 SiO2+Na2CO3 Na2SiO3+CO2↑中, SiO2“置换”CO,则与酸性强弱无关,而是依据熵增原 理发生的反应.其实,类似上述“互相矛盾”的反应还有很多,比如:2Mg+SiO2
Na2SiO3+CO2↑中, SiO2“置换”CO,则与酸性强弱无关,而是依据熵增原 理发生的反应.其实,类似上述“互相矛盾”的反应还有很多,比如:2Mg+SiO2 Si + 2MgO。
Si + 2MgO。
在实验室里可利用酒精喷灯加热镁粉与SiO2粉末的混合物制取粗硅并进一步试验硅的化学性质,此反应利用了镁的还原性。而工业上则可利用粗硅还原氧化镁的方法制取金属镁:2MgO + Si  SiO2+2Mg (蒸气)。显然,这一反应是因为产生的镁呈气态,整个反应过程中燜的增大拉动化学平衡不断向右移动。
SiO2+2Mg (蒸气)。显然,这一反应是因为产生的镁呈气态,整个反应过程中燜的增大拉动化学平衡不断向右移动。
同理,还有2Mg + CO2  C + 2MgO(实验室可以演示镁条在CO2中的燃烧);MgO(s) + C(s)
C + 2MgO(实验室可以演示镁条在CO2中的燃烧);MgO(s) + C(s) CO(g) + Mg(g)(工业制取镁的方法之一,应用熵增原理)。
CO(g) + Mg(g)(工业制取镁的方法之一,应用熵增原理)。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
高中化学中的“玻璃”主要分为两大类:真玻璃(硅酸盐玻璃)...
...
【引子】2014年上海高考的第32题:将黑色的Fe 2 S 3 固体加入足量...
1(最佳提问).常温下硅的化学性质不活泼,为什么自然界没有...
1.实验室盛放碱液的试剂瓶要用橡胶塞而不能用玻璃塞,原因是...
沙,砂:大有学问 “沙”和“砂”:共同点,体积小 汉字“沙...