
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
早在19世纪50年代,Frankland在考察元素相互化合的原子比时就提出了最原始的化合价的概念。把氢的化合价定为1,则和氢形成HCl,H2O,NH3,CH4的氯,氧,氮,碳的化合价便为1,2,3,4。它们彼此相互化合时,也会呈现这种化合价的相互关系,例如,碳和氯的化合物(CCl4)里的原子比为1:4,因为氯和氢化合价相同,所以CH4和CCl4符合同一个通式AB4;而碳和氧的化合物(CO2)里的原子比为1:2;因为氧的化合价是2,一个氧原子可以相当2个氢原子等等。当时的化学家们并不清楚化合价的实质,解释不了为什么不同的元素有不同的化合价,也解释不了为什么有变价。但却发现,化合价是元素性质的异同性以及分类的重要依据之一。例如,碱金属都表现1价,碱土金属都表现2价等等。以化合价等概念为基础的对元素的分类考察后来形成了门捷列夫发现元素周期律的出发点。
原始的化学键概念是为了形象地表达原始的化合价的概念提出的,没有任何结构上的实在含义。例如,为了表达化合价,可以用一根线段表示一价,把相互化合的原子连接起来,并把“—”、“=”和“≡”分别称为单键、双健和叁键。到本世纪初,在原子结构模型的基础上,路易斯(1916年,G.C.Lewis,美国化学家)提出了化学键的电子对理论。他认为,原子相互化合形成化学键的过程可以简单地归结为未成对电子的配对活动。当A原子的一个未成对电子和B原子的一个未成对电子配成一对被双方共用的电子对,就形成一个化学健,这种化学键称为“共价键”。这样,就可以把表示化学健的“—”。改成“:”,以表示一对电子。这种化学符号就是所谓共价键的“电子结构式”。
路易斯的共用电子对理论阐明了化学键的实质。至今仍有重要的意义。几乎与提出共价键的同时;人们还建立了配价键和电价键(即离子键)的概念。当A原子和B原子化合,A原子供出一对电子对而B原子接受这对电子对,形成一对共用电子对,所形成的化学键就称为“配价键”。当A原子和B原子形成化学键时,A原子的未成对电子和B原子的未成对电子配成对,但这对电子并不是共用电子对而是为一方所独有,这样,一方失去电子,变成正离子,另一方得到电子,变成负离子,正负离子以静电引力相互吸引,形成的化学键称为“电价键”或称为“离子键”。
所谓“路易斯结构式”,通常是指如下所示的化学符号:
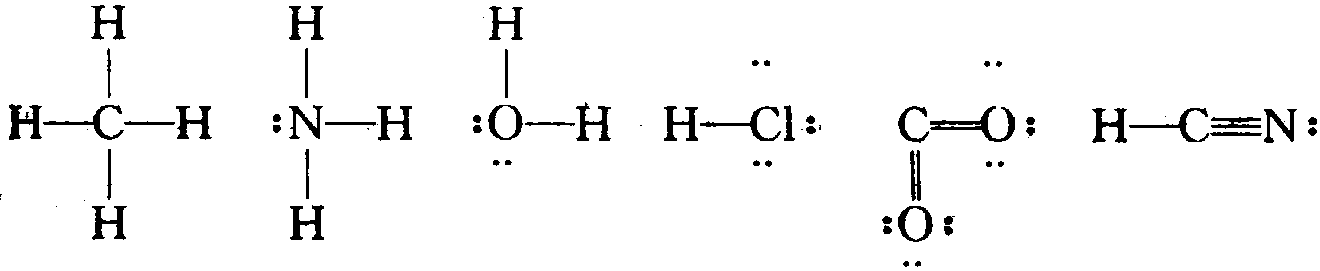
在路易斯结构式中,线段的意义,如前所述,代表共用电子对,仍称“单键”、“双键”和“叁键”(代表1,2,3对共用电子对)。成对的小黑点则代表未用来形成化学键的“价层电子对”,叫做“孤对电子对”(有时分子里有单个的非共用电子,如NO2)。
对于大多数有机化合物,通过观察便可写出他们的路易斯结构式。这是因为,在大多数有机化合物里,C、H、O、N、S、卤素等元素的化合价是稳定的,只要掌握它们的化合价,注意到在化合物里每个原子周围的价层电子的总数等于8(所谓“八偶律”),就可以写出它们的路易斯结构式。
对于无机物,写路易所结构式就要困难得多。但大多数情况下,“八偶律”仍是起作用的。从上面已经写出的路易斯结构式里我们很容易发现这一点。但有时八偶律不起作用。主要有两种例外。
①缺电子结构——价电子,包括形成共价键的共用电子对之内,少于8电子的,称为缺电子结构。例如,第3主族的硼和铝,中性原子只有3个价电子,若一个硼原子和其它原予形成3个共用电子对,也只有6个电子,这就是缺电子结构。典型的例子有BCl3、AlCl3(这些化学式是分子式,即代表一个分子的结构)。缺电子结构的分子有接受其它原子的孤对电予形成配价键的能力。例如:
BCl3+:NH3=Cl3B←NH3
能够接受电子对的分子称为“路易斯酸”,能够给出电子对的分子称为“路易斯碱”。路易斯酸和路易斯碱以配价键相互结合形成的化合物叫做“路易斯酸碱对”。
②多电子结构例如,PCl5里的磷呈5价,氯呈1价。中性磷原予的价电子数为5。在PCl5磷原子的周围的电子数为10,超过8。这种例外只有第3周期或更高周期的元素的原子才有可能出现。
有时,一个分子在不改变其中的原子的排列的情况下,可以写出一个以上合理的路易斯结构式,为解决这一问题,鲍林提出所谓的“共振”的概念,认为该分予的结构是所有该些正确的路易斯结构式的总和,真实的分子结构是这些结构式的“共振混合体”。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明:本文介绍了化学键的本质及其分类。文章详细介绍了价键...
手性碳原子 是指人们将连有四个不同基团的碳原子形象地称为手...
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...