
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
为什么NH3的熔沸点比H2O的熔沸点低得多?
水和氮族元素氢化物的熔点、沸点数据见表1。由表1可知:NH3的熔点和沸点大大高于从同族元素氢化物序列外推得到的数值。
表1一些氢化物的熔点、沸点数据
这是由于NH3分子间存在着氢键的缘故。但是,NH3的熔沸点却比H2O的熔沸点低得多。
一般认为,和H2O相比,氢键对NH3的影响要来得弱些。相关数据表明,冰中O—H…O氢键的作用能为18.8 kJ•mol-1,固体氨中N—H…N氢键的作用能为5.4 kJ•mol-1。
据此可以认为,氢键对NH3的影响减弱很大程度上可归结于NH3分子间形成氢键的能力弱于H2O分子。
为什么固体氨和液态氨中的氢键比冰和水中的氢键弱呢?
原因有两点:一是由于N的电负性(X=3.0)比O的电负性(X=3.5)小,故N—H键的极性比O—H键的极性小,因此只有较小的生成氢键的能力。
二是因为NH3分子中只有一对孤对电子,在与其他分子的N—H基生成氢键时,这对孤对电子必须是对质子的引力的来源。
而H2O分子中的每一个氢键都有一对孤对电子。
另有文献表明,固体氨的结构比冰的结构更复杂。
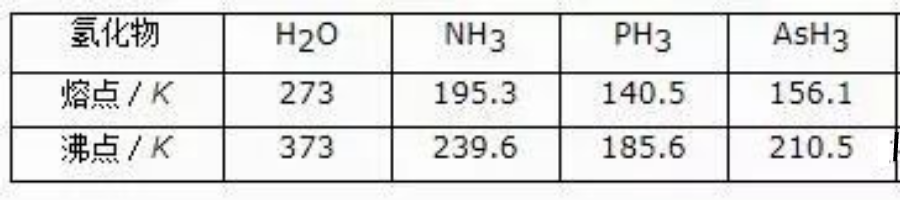
在氨的晶体中,每个氮原子周围有六个最邻近的氮原子,与它各相距3.38埃,这个距离表明N—H…N(是一个弱的氢键)(较强的N—H…N键的键长是2.94~2.99埃)。
这种“结构单元”通过不对称的、非线形的氢键连接起来。和中心氮原子键合的三个氢原子分别和另外三个氨分子形成氢键。中心氨分子的氮原子又通过氢键和其他三个氨分子结合,实际上每个氮原子和六个氢原子连接,其中三个为正常的共价键,三个相当于氢键的距离(见图4)。
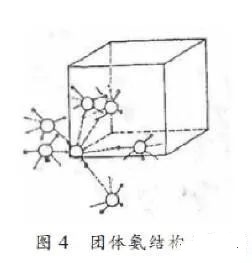
图4固体氨结构示意图
在固体氨中,H—N—H的键角和气态氨接近,但N—H键的键长却比气态氨中明显地增长。资料显示:氨分子能形成聚合体,通式为(NH3)n(n=1~6)。其中(NH3)2呈极性,其结构中仅含一个氢键;n≥3的聚合体则为非极性,此与环状的氢键结构相符(见图5)。
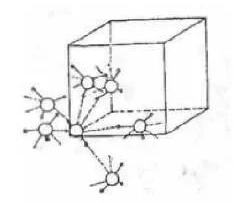
图5氨分子的二聚体与三聚体的结构
当固态氨熔化时,NH3中只有26%的氢键断裂;从熔点加热到沸点的过程中,只有7%的氢键断裂。
综上所述,和H2O相比,NH3有较低的熔点和沸点的原因主要有三点:
一是在氨的晶体中,虽然每个氨分子可以参与形成六个氢键(每个氨分子分享到三个氢键),但N的电负性较O的小,形成的N—H…N氢键较弱。
二是每个氨分子中只有一对孤对电子,不能形成交联网络。
三是固态氨熔化、沸腾时只有部分氢键断裂,液氨和氨气中还存在部分氢键。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。氢键 氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原...
在“键的极性对化学性质的影响”一节中,高中阶段将会学习诱导效应对羧基的羟基的极性...
孤对电子,英文名:unshared pair electrons;lone pair electrons分子中除了用于形成...
1.共价键是如何形成的? 自旋相反的未成对电子可配对形成共价键,共价键的本质是在原...
问题①: 第三周期中的几种非金属元素的氢化物的沸点: CH 4 NH 3 H 2 O ,为什么? ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...