
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、简单立方堆积
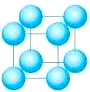
在简单立方堆积的晶胞中,晶胞边长a等于金属原子半径r的2倍,晶胞的体积V晶胞=(2r)3 。晶胞上占有1个金属原子,金属原子的体积V原子=4πr3/3,所以空间利用率V原子/V晶胞= 4πr3/(3×(2r)3 )=52.33﹪ 。


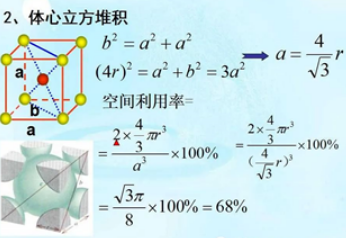
二、体心立方堆积
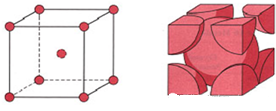
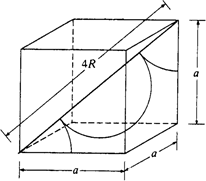
体心立方堆积晶胞中,体对角线上的三个原子相切,体对角线长度为原子半径的4倍。
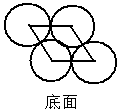
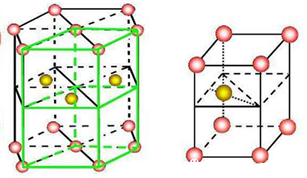
三、六方最密堆积
六方最密堆积的晶胞含有2个原子。不再是立方结构。晶胞上、下两个底面为紧密堆积的四个原子中心连成的菱形,边长a = 2r ,夹角分别为60°、120°。底面积s = 2r×2r×sin60°。晶胞的高h的计算是关键。在晶胞的上、下两层紧密堆积的四个原子中,各有两个凹穴,中间层的原子在上、下两层正对的凹穴中。中间层的原子和上层形成凹穴的三个原子构成一个正四面体;和下层对应的三个原子也构成一个正四面体,这两个正四面体的高之和就是晶胞的高。

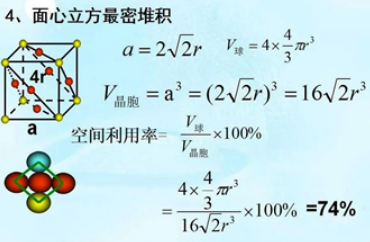
四、面心立方最密堆积
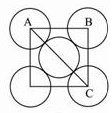
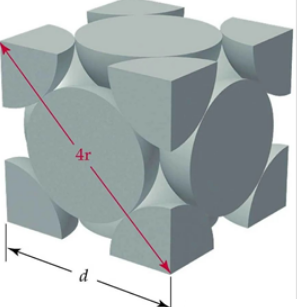
在面心立方最密堆积的晶胞中,面对角线长度是原子半径的4倍。假定晶胞边长为a,则a2 + a2 = (4r)2 ,a = 2√2r ,晶胞体积V晶胞=16√2r3 。面心立方堆积的晶胞上占有的原子数为4,原子占有的体积为V原子 = 4×(4πr3/3)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。金刚石晶胞中的原子排列方式图进行计算。 ①空间占用率的计算: 图中的原子数目计算:...
微粒间距离的计算常常涉及晶体密度、 N A 、 M 、晶体体积等数据,解答这类题目时,一...
晶胞投影问题是 《 物质结构与性质 》 这一 部分的重点和难点 , 在高考中考查起点高...
金刚石晶胞的原子坐标 取向一: 取向二: 氟化钙晶体: 每个CaF 2 晶胞有4个Ca 2+ 和...
一、方法介绍 图 右手坐标系 原子的坐标就是用向量中xa+yb+zc中的(x,y,z)表达晶胞中...
1.简单立方晶胞投影 如图3-1为简单立方晶胞模型,为方便表述方向,建立如图所示的空间...