
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、灯泡(灯管)内为什么要填充氮气与氩气的混合物?
灯泡(灯管)是靠金属钨丝导电、发光的,为防止高温下钨丝的氧化,就必须把其中的空气排出。早期也有这样的真空灯泡,但是后来人们发现真空状态下钨丝的挥发很快,一方面缩短了灯泡的寿命,另一方面挥发的金属钨沉积在灯泡内壁形成一薄层黑色物质影响灯泡发光强度,加之真空灯泡要承受外界压力,相对易碎,所以后来就采取充入N2、Ar混合气体的生产工艺。说N2、Ar混合气体,其实并不一定是刻意为之,也许只是把普通空气除去O2之后的剩余气体回充到灯泡内而已。
工业上在焊接一些比较活泼的金属时,也用氮气作为保护气.就是在焊接部位持续通入N2,利用N2驱赶走周围的空气,避免焊接过程中金属件的氧化。
2、在大型粮仓内充入N2有何好处?
粮仓内充入氮气的目的是排出其中的空气,由于N2不支持呼吸,一方面可以使粮仓内的老鼠等噬食粮食的小动物无法生存,藏身于粮食中的各种昆虫也会窒息死亡;另一方面也抑制了粮食(本身是植物种子,会呼吸消耗自身养分)的呼吸,延长其保存期且保持住营养成分。当然,充氮粮仓在一定程度上还具有防止火灾的作用。
食品加工业上,为防止包装在塑料袋内的蛋糕、饼干等受到外界挤压,也有采取充氮包装的工艺,不充入空气的原因是为了防止食物中的油脂被氧气氧化。
通过氮气的这些特殊用途我们看到,对于气体来说,支持呼吸(燃烧)有支持呼吸(燃烧)的用途(如O2),不支持也可以有不支持的应用,这就是辩证法。
3、为什么科学上把高温超导体的超导温度定义为高于N2的沸点(-196℃)?
自从科学家发现在极低温度下某些金属具有超导效应以来,超导材料研究是近几十年来的热门领域,因为运用超导输电可以做到输送过程中能量几乎无损耗。
我们知道,金属材料导电靠自由电子的定向移动,金属材料通常因电子、金属离子的热运动而产生电阻,所以导电的同时会发热,从而导致能量损耗。在极低的温度下,金属离子在晶格上的振动幅度大为降低,对自由电子的阻碍作用大为减弱,所以导电能力大大增强。
要使超导材料能够真正投入实际应用,就要设法制造出它形成超导能力所需的低温,低温介质在实验室里可以不计成本,比如运用液态氦等。而要使低温介质投入使用则必须考虑取材方便、价格合理,以及泄漏时对环境的影响等诸多方面。N2作为大气的主要成分,是比较合适的低温介质。所以人们认为只有获得临界温度与液氮温度匹配甚至高于N2沸点的超导材料,超导才能真正走上应用的轨道。
除了超导低温介质外,液氮在现代物理、化学、生物学、医学诸多研究领域中也有极为广泛的应用,如利用液氮的低温,医疗上设计了液氮冷冻法去除皮肤表面生长的疣等赘物的简易手术;还有人提出了利用液氮替代干冰进行人工降雨的设想。
4、N2很不活泼,能不能由此说明氮元素非金属性不强?
首先我们要明确,元素和单质不是一个概念,单质的性质可在一定程度上反映出元素某些方面的性质,但也不尽然。元素的非金属性一般根据元素的电负性判断,常见非金属元素中,氟的电负性最大,为4.0,其次是电负性为3.5的氧,再其次则当属氯元素和氮元素了,这2种元素的电负性均为3.0,这说明氮元素是一种非金属性非常强的元素。从氮的气态氢化物NH3的稳定性以及氮的最高价氧化物水化物HNO3的酸性也可判断氮元素的非金属性很强。
N2之所以性质稳定,主要与其分子结构有关,N2分子内2个氮原子之间形成了3对共用电子(共价三键),一般情况下,N2要参加化学反应,则必须先打开这个三键,这需要极高的能量(N≡N的键能946kJ·mol-1),即N2参与化学反应时需要的活化能非常高.比如合成氨的反应,虽然从热力学的角度看是放出能量的自发反应,但是动力学却要“高温、高压、催化剂”这样十分严苛的条件.
5、实验室如何制取N2?
目前,大多数实验室所用纯N2都是购买工业产品—储存在钢瓶里的氮气,然而临时需要少量纯净N2时,可以采用NH4Cl与NaNO2溶液反应的办法获得,反应方程式为NH4Cl+NaNO2=NaCl+N2↑+2H2O,装置如图1所示。
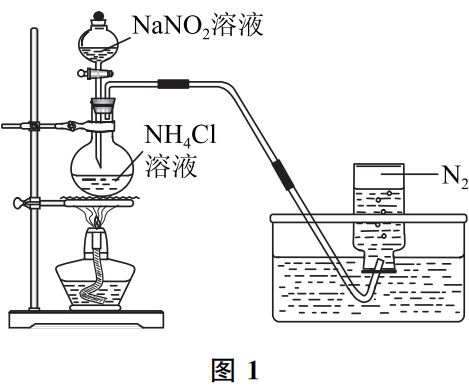
该反应原理是利用NaNO2中+3价氮元素氧化NH4Cl中-3价氮元素实现的,亚硝酸盐中+3价氮很不稳定,具有较强的氧化性(当然也有还原性,比如被酸性高锰酸钾溶液氧化为NO3-),有机化学上也利用这一性质氧化氨基(产生N2),以分析有机化合物中氨基的含量。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸的氧化性 酸的氧化性指的是,酸在溶液中电离出H + ,H + 在化学反应中被还原为H 2...
一. 比水重 双氧水分子比水多一个氧原子,物理性质各方面都“重”,好比 CO 2 与 CO ...
1.为什么市售浓硫酸的浓度是98.3%? 市售的浓硫酸就是硫酸的恒沸溶液。在常压下,加热...
H2SO4=硫酸,H3PO4=磷酸,H2CO3=碳酸,HNO3=硝酸? 从英文命名来看,硝酸本来就是“氮...
工业制取硫酸分为三个阶段: 第一阶段:含硫矿物燃烧产生SO2 原料与设备:硫磺或黄铁...
在中学化学中,我们学习了多种气体,氨气是唯一的碱性气体。俗话说,明枪易躲,暗箭难...