
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
《普通高中化学课程标准(实验)》在课程内容标准部分提出了下列要 求:(1)设计实验证明某些化学反应的可逆性;(2)能用焓变和熵变说明化学反应的方向。按照化学课程标准编写的不同版本的高中化学教材都涉及了化学反应的自发性和可逆性的概念,但在化学教学中发现,不少中学化学教师对化学反应的自发性和可逆性的理解存在一定的偏差,如何正确理解反应的自发性和反应的可逆性呢?
1. 反应的自发性
由化学热力学可知,一个反应能否自发进行可以用吉布斯自由能变 (ΔG)来判断。ΔG<0时,反应能自发进行;ΔG= 0时,反应处于平衡状态; ΔG > 0时,反应不能自发进行。
对于化学反应:aA (g) +bB(g) ==gG(g) +hH(g)
其反应的ΔG可表示为
ΔG = ΔH -T • ΔS
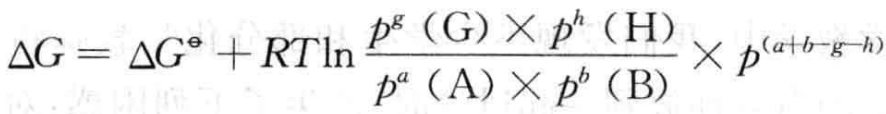
化学反应的吉布斯自由能变ΔG与反应的熵变ΔS和焓变ΔH有关,但 在中学化学课程中讨论ΔG还缺乏一定的基础,因此,在《普通高中化学课程 标准(实验)》中仅提出了“能用焓变和熵变说明化学反应的方向”的基本要求。
从ΔG的表达式还可以看出,化学反应的ΔG是由反应的本质(ΔGΦ)和 反应条件(T、P)所决定。因此,高校和中学的化学教材对自发反应给出的 定义都强调了反应条件。如高校的无机化学教材中将自发反应定义成:如果在给定的条件下,一个反应可以自发地正向进行到显著程度,称为自发反应;在高中化学教材(如江苏教育出版社出版的《化学反应原理(选修)》)中 将自发反应定义为:在一定条件下,不需外界帮助就能正常进行的反应称为 自发反应。虽然上述几个自发反应的定义不完全相同,但都提到了“一定条 件”,这里所说的一定条件就是指一定的温度和压强。
但是,在中学化学教学中,不少学生甚至部分中学化学教师常将自发反 应中所讲的“一定条件”与我们书写化学方程式时所注明的“反应条件”相混淆。实际上化学方程式上注明的反应条件,如点燃、高温、加热、催化剂等是 指反应能被显著地观察到从左向右进行所需要的条件,而定义自发反应所讲的“一定条件”是指“一定的温度和压强”。如我们把氢气和氧气放在一 起,并没有看到有水生成(反应速率很慢,但该反应是自发反应),但如果在氧气中将氢气点燃,就观察到迅速有水生成,因而通常将氢气和氧气反应的化学方程式写成2H2 +O2  2H2O;又如合成氨反应,我们都要在化学方程式上注明反应条件为“高温、高压、催化剂”,但合成氨反应在室温和常压下也是自发的。
2H2O;又如合成氨反应,我们都要在化学方程式上注明反应条件为“高温、高压、催化剂”,但合成氨反应在室温和常压下也是自发的。
为了防止在中学化学教学中将自发反应所讲的“一定条件”与化学方程式上所注明的“反应条件”相混淆,我们建议将中学化学教材中自发反应的定义描述 成:在一定温度和压强下,不需外界帮助就能正常进行的反应称为自发反应。
2.反应的可逆性
对于化学反应的可逆性,几乎所有的化学教材中都将其定义成:在相同的 条件下,一个化学反应既可按化学方程式从左向右进行,又可以从右向左进行,这就是化学反应的可逆性;在同一条件下,能同时向正、反两个方向进行的 化学反应称为可逆反应。
在中学化学教学中,我们发现不少学生和部分化学教师将化学反应的可 逆性与化学反应的自发性放到一起讨论时,产生了下列困惑。对于可逆反应而言,如果正反应是自发的(ΔG<0),则逆反应必然是非自发的(ΔG>0),非自发反应怎么可以进行呢?在这次化学课程改革之前的中学化学课程中,由 于不讨论反应的自发性,仅讨论化学反应的可逆性,就不可能遇到上述的困惑。这是这次化学课程改革在中学化学课程中增加了反应的方向性的教学要求所带来的新问题。
其实,反应的自发性和反应的可逆性并不矛盾。可逆反应是指“在同一条 件下,能同时向正、反两个方向进行的化学反应”,这里所指的“同一条件”也是 指“相同的温度和压强”。例如,对于合成氨反应
N2 (g) + 3H2 (g)  2NH3 (g)
2NH3 (g)
在673 K,反应物和生成物的分压都是1. 01×105Pa时,ΔG= 41. 7kJ • mol-1,该 反应正向非自发进行,说明673 K时,分压都为1. 01×105 Pa的N2(g)与 H2(g),不可能不需要外界帮助就生成分压为1. 01×105 Pa的NH3(g)。但并 不是说该条件下,N2 (g)与H2 (g)就不能生成NH3 (g) 了,通过计算可知:若N2 (g)与]H2(g)的分压均为1.01× 105 Pa,达到平衡时NH3(g)的分压为2. 43× 103 Pa。也就是说一个非自发反应,没有外界的帮助并非完全不能进行。
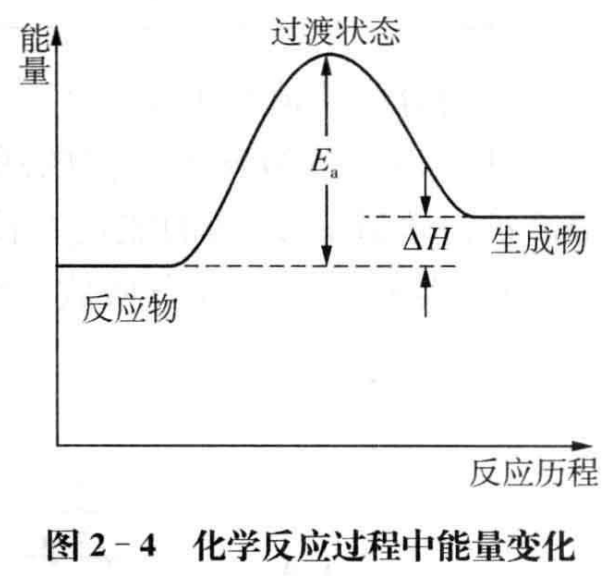
如何理解非自发反应并非“完全不能进行”呢?这需要将热力学和动力学 结合起来讨论。图2-4给出了任一吸热化学反应的反应历程示意图,从图中我们可以发现,无论是反应物还是生成物,其中活化分子都能通过碰撞形成相同的过渡状态,而过渡状态既可以转化为生成物也可以转化为反应物,表现为反应的可逆性,对不同的化学反应,过渡状态向生成物转化和过渡状态向反应物转化的程度不同。从这层意义上讲,任一化学反应都是可逆反应,仅仅是可逆的程度不同而已。
综上所述,我们认为化学反应的自发性和化学反应的可逆性是从不同的 视角对化学反应进行的讨论,在一定条件下的自发反应,在相同条件下其逆反应并非完全不能进行。而在中学化学教学中,由于学生化学基础知识的不足, 最好不要将反应的自发性和反应的可逆性放到一起进行讨论。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准(实验)[M].北京:人民教育出版社,2003
[2] 华彤文等.普通化学原理[M].第3版.北京:北京大学出版社.1993
[3] 王祖浩等.普通高中课程标准实验教科书化学反应原理(选修)[M].南京:江苏教育 出版社.2006

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1 、焦炭在高温下与水蒸气的反应。本反应的主要产物是 CO 和 H 2 ,并非 CO 2 和 H 2 ...
《普通高中化学课程标准(实验)》在课程内容标准部分提出了下列要 求:(1)设计实验...
1889年,瑞典化学家阿伦尼乌斯最早提出了活化能的概念。阿伦尼乌斯将普通分子转化为活...
第二页 第三页 第四页 第五页 第六页 第七页 第八页...
化学平衡理论是中学化学的重要理论之一,也是 教学的重点和难点。恒温、恒压是化学实...
化学平衡常数是高考考试大纲新增内容。从近几年的高考中发现,化学平衡常数早已成为高...