
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
溶液的酸碱性对许多化学反应有很大的影响,在中学化学教学中经常会遇到这方面的例子:
①实验室用MnO2与浓盆酸反应制备少量氯气:MnO2+4 H++ 2Cl-==Mn2++ 2H2O+Cl2
②检验乙烯通常用酸性KMnO4溶液。
③用Cu(OH)2的强碱性溶液检验醛基。
在氧化还原反应体系中,溶液酸碱性的影响是多方面的,总结起来,在中学化学课程范围内,主要有以下几个方面。
(1)影响氧化还原反应进行的程度
氧化还原反应进行的程度与反应中的氧化剂和还原剂的强弱有关。氧化 剂的氧化性越强,还原剂的还原性越强,氧化还原反应进行得越完全。一个氧 化还原反应,如Cl2+2Br-==2Cl-+Br2是由两个“半反应”(又称为电极反应)组成的。
Cl2+2e-=2Cl- 2Br-2e-=Br2
其反应倾向及完全程度可由两个半反应电极电势的差值(电动势)判断。电极电势是氧化剂和还原剂强弱的重要定量标度,电动势是氧化还原反应进行程度的重要度量。

严宣申教授曾假设,凡达到平衡时生成物浓度分别是反应物浓度的100 倍的反应认为是完全反应,凡达到平衡时反应物浓度分别是生成物浓度的100倍的反应认为是难以进行的反应。根据这一假设,氧化还原反应可分为如表 2-10所示的3种类型。
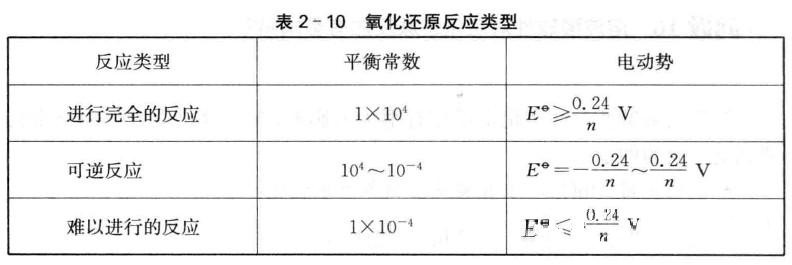
通常情况下,人们根据判断氧化还原反应的倾向和完全程度。如实验 室制取Cl2可分别用盐酸和MnO2、K2Cr2O7、KMnO4等反应,但据
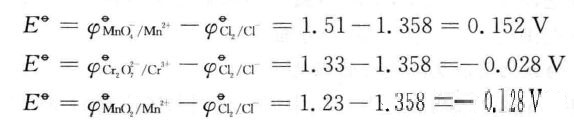
所以,在标准状态下只有KMnO4氧化HCl是能自发进行的,而K2Cr2O7、 MnO2与HCl的反应难进行。对于反应MnO2+2Cl-+4H+==Mn2++Cl2+2H2O:
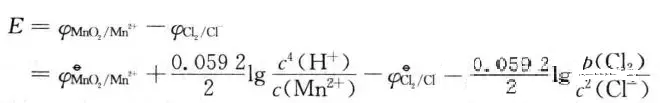
若使反应自发进行,必须E≥ 0,计算发现E≥0要求C( H+)≥5. 3 mol • L-1, 故浓盐酸(12 mol • L-1可与MnO2反应制备氯气,实验室通过上述反应制备 氯气时,加热的目的是为了增大反应速率。
上述实验事实说明,在有H+或OH-参加的氧化还原反应中,溶液酸碱性 的改变会使氧化剂的氧化性或还原剂的还原性发生改变,进而影响氧化还原 反应进行的程度,甚至改变反应的方向。如反应3I2+6OH-== IO3-+ 5I-+ 3H2O,在碱性溶液中反应正向进行,而在酸性溶液中反应逆向进行。本文来自化学自习室!
对于KMnO4作氧化剂的反应,溶液的酸度对其氧化性的强弱有很大的於 响。由于反应MnO4-+8H++5e-=Mn2++4H2O的电极电势为
![]()
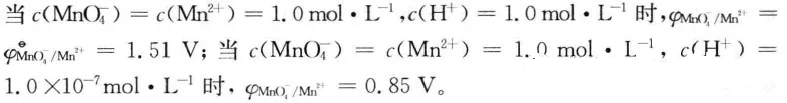
计算结果说明,如果H+或OH-在电对的半反应中出现,其浓度的改变会 导致该电对的电极电势发生改变,也就是说会改变氧化剂或还原剂的强弱。中学化学实验中通常用酸性KMnO4溶液作氧化剂,就是为了增强KMnO4的氧化性。
(2)影响氧化还原反应的产物
有这样一个化学实验能够很好地说明溶液酸碱性对氧化还原反应产物的 影响:在三个烧杯中分别加入等体积的稀硫酸、蒸馏水和浓氢氧化钠溶液,再 各加入等体积的KMnO4溶液,然后分别滴加亚硫酸钠溶液,同时不断地进行 搅拌。我们可以看到:
(1)在盛有稀硫酸的烧杯中,KMnO4的紫红色消失了, 得到无色透明的液体;
(2)在盛有蒸馏水的烧杯中,KMnO4的紫红色消失了, 得到棕色的沉淀;
(3)在盛有浓氢氧化钠溶液的烧杯中,KMnO4的紫红色消失 了,得到绿色的溶液。
同样是高锰酸钾和亚硫酸钠的反应,在酸性、中性、碱性介质中产生的现 象不同,这说明得到的产物不同。为什么会这样呢?因为溶液的酸度可以改变氧化还原反应的产物。
①在酸性介质中,高锰酸根被亚硫酸根还原成Mn2+,所以其紫色褪去,生 成的Mn2+在浓度大的时候呈粉红色,浓度小的时候看不出颜色,因此 溶液看起来是无色透明的。反应的离子方程式为
2MnO7+5 SO32-+ 6H+= 2Mn2+十 5SO42-+ 3H2O
②在中性介质中,高锰酸根被亚硫酸根还原成MnO2,所以其紫红色褪去, 得到棕色的MnO2沉淀。反应的离子方程式为
2MnO4-+ 3SO32-+ H2O= 2MnO2 + 3SO42-+ 2OH-
③在强碱性介质中,高锰酸钾被亚硫酸根还原成MnO42-,所以其紫红色褪 去,得到绿色的MnO42-,因此溶液呈绿色。反应的离子方程式为
2MnO4-+ SO32-+ 2OH-=2MnO42-+ SO42-+ H2O
在中学化学课程中,在不同酸碱性的溶液中氧化还原反应得到不同产物 的实例还是不少的。例如,Cl2与碱溶液反应时,稀碱中生成ClO-,浓碱中生 成ClO3-;Fe3+与S2-在溶液中反应时,在酸性介质中生成Fe2+和S,在碱性介质中得到Fe2S3、Fe(OH)3、FeS、S等,反应比较复杂。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化合价 化合价是一种元素的一个原子与其他元素的原子化合【即构成化合物】时表现出来...
氧化剂 还原剂 活泼非金属单质:X 2 、O 2 、S 活泼金属单质:Na、Mg、Al、Zn、Fe 某...
常见阴离子还原性强弱顺序:S 2- SO 3 2- I - Fe 2+ Br - Cl - OH - 含氧酸根 F - 最常...
1. 得电子物质被还原是氧化剂。 2. 失e物质、被还原、发生了还原反应。 3. 氧化剂...
常见的强氧化剂简介 具有强烈氧化性的物质。在标准电位顺序中的位置越靠后,标准电位...
非金属单质氧化性: 一般情况下元素非金属性强的对应的单质氧化性强。 例如:非金属性...