
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
既能跟强酸(H+)反应,又能跟强碱(OH-)反应的化合物可称为两性化合物。包括两性氧化物、两性氢氧化物、弱酸的酸式盐以及氨基酸等。
1.铝、氢氧化铝、氧化铝的两性
(1)2Al+6H+==2Al3++3H2↑
2Al+2OH-+2H2O==2AlO2-+3H2↑
(2)Al2O3+6H+==2Al3++3H2O
Al2O3+2OH-=2AlO2-+H2O
(3)Al(OH)3既能与强酸反应又能与强碱反应:
Al(OH)3既能与强酸反应又能与强碱反应,说明Al(OH)3必须同时能电离出H+和OH-,即能发生“两性电离”:
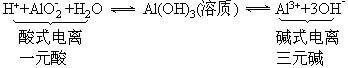
根据平衡移动原理,:当向上述平衡体系中加强酸,[H+]增大,同时又中和OH-使[OH-]下降,平衡向右移动,结果Al(OH)3逐渐溶解成Al3+;当向上述平衡中加强碱,[OH-]增大,同时又中和H+使[H+]下降,平衡向左移动,结果Al(OH)3固体逐渐溶解成为AlO2-。
相关方程式:Al(OH)3+3H+==Al3++3H2O(不能与H2CO3等弱酸反应)Al(OH)3+OH-==AlO2-+2H2O(不能与氨水等弱碱反应)
2.Be(OH)2或H2BeO2(铍酸)的两性
与Al(OH)3相同Be(OH)2存在如下两性电离:2H++BeO22-![]() Be(OH)2
Be(OH)2![]() Be2++2OH-
Be2++2OH-
Be(OH)2+2H+==Be2++2H2O
Be(OH)2+2OH-==BeO22-+2H2O
3、Zn(OH)2或H2ZnO2(锌酸)的两性:
Zn(OH)2+2H+==Zn2++2H2O
Zn(OH)2+2OH-==ZnO22-+2H2O
注意:Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+。
4、弱酸的酸式盐的两性
(1)实例:NaHCO3、NaHS、NaH2PO4、Na2HPO4等。
(2)本质:酸式盐的阴离子在水中亦存在两个平衡:
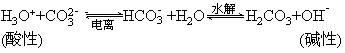
所以它们均既能与强酸反应又能与强碱反应,如:
NaHS+HCl==NaCl+H2S↑
NaHS+NaOH==Na2S+H2O
5、氨基酸的两性
氨基酸分子既有酸性的羧基,又有碱性的氨基,因此和酸碱均能反应生成盐,是一种两性化合物。而且氨基酸分子中的氨基与羧基还可形成内盐。氨基酸的水溶液中,存在如下平衡:
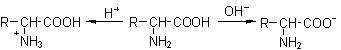
在强酸性溶液中,氨基酸以阳离子形式存在;在强碱性溶液中,则主要以阴离子形式存在;氨基酸在一般情况下不是以游离的羧基或氨基存在的,而是两性电离,在固态或水溶液中形成内盐:
![]()

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1.葡萄糖与果糖互为同分异构体 2.蔗糖与麦芽糖互为同分异构 3.淀粉与纤维素不是同...
既能跟强酸(H + ) 反应,又能跟强碱(OH - )反应的化合物可称为 两性化合物 。包括两性...
1、油脂是“油”和“脂肪”的总称,那么“油和“脂”到 底有何异同? 油脂的主要化学...
(1)葡萄糖的化学性质小结 ①氧化反应 CHO(COOH) 4 CH 2 OH+2 [Ag(NH 3 ) 2 ] + +2 ...
...
...